FAG Aktuelt
Genomet er som et flokete nøste
Epigenetikken forvandler bildet av det menneskelige genom. Det vi har sett for oss som en streng av DNA er mer som et flokete nøste. Strukturen og plasseringen i cellekjernen bærer viktig informasjon.
Av KRISTIN STRAUMSHEIM GRØNLI, frilansjournalist
– Muligheten for å kunne se tredimensjonalt på genomet er den tredje store fasen i kartleggingen av genomet, sier Philippe Collas, professor ved Institutt for medisinske basalfag ved Universitetet i Oslo (UiO).
For 20 år siden, da det menneskelige genom ble sekvensert av The Human Genome Project, handlet det om gener på en lineær sekvens. Et knapt tiår seinere kom en vitenskapelig revolusjon da forskerne ble i stand til å lese epigenetiske endringer i genomet.
– De siste årene har vi fått muligheten til å sette alt dette inn i en 3D-kontekst, sier Collas.

– Trodde vi visste
Den teknologiske utviklingen medfører stadig mer data om genomet – mye mer enn det genene står for alene. Informasjonen blir også mer sammensatt.
– På 2000-tallet trodde vi at vi visste nesten alt om genomet, sier Ragnhild Eskeland, førsteamanuensis ved Institutt for medisinske basalfag ved UiO.
– Siden har vi oppdaget lag på lag med molekylære finesser som kontrollerer genene.
Epigenetikken beskriver disse finessene. Det dreier seg om mekanismer som styrer hvordan friske celler utvikler seg og danner kroppens celler og vev. Når slike mekanismer svikter, kan det lede til sykdom.
Da det menneskelige genom først ble kartlagt, var oppfatningen at under to prosent av hele genomet var viktig. Årsaken er at kun disse DNA-sekvensene (genene) produserer proteiner.
Resten kalte man rett og slett junk-DNA, altså søppel – siden ingen ante hva det var godt for.
Epigenetiske merker
– Nå vet vi at mye av dette søppel-DNAet er viktig for å styre aktiviteten til genene våre, og at dette skjer via epigenetiske merker, sier Eskeland.

Merkene er kjemiske grupper som enten fester seg direkte på DNA-et, eller på histonene – proteinene som pakker DNA inn i cellekjernen.
Merkene styrer den romlige organiseringen av genomet inne i cellekjernen. Både pakkegrad og relativ plassering av DNA-segmenter styrer genuttrykket – et mål på hvor aktivt et gen er i en celle. Genene kan være av, på eller dimmet i ulik grad.
– Resten av DNA-et er altså ikke søppel, men har viktige regulerende roller, sier Eskeland.
Cellene glemmer
Genomet ligger beskyttet inne i cellens kjerne og er likt for alle celler i en kropp, med noen få unntak. Epigenomet varierer derimot fra celle til celle og fra cellestadium til cellestadium.
«Epi» stammer fra gresk og betyr på, utenpå eller i tillegg til. Epigenetikk handler altså ikke om endringer i selve DNA-sekvensen, men noe som kommer i tillegg.
– Vi kan si at cellene må bruke genomet forskjellig. De har ulike epigenetiske kart, forklarer Rein Aasland, professor ved Institutt for biovitenskap ved UiO.
Han har forsket på epigenetikk siden det var et bittelite felt for bananflueforskere og noen få andre «nerder». Nå jobber han blant annet med å forstå histonenes rolle i genreguleringen.

– En veldig viktig del av epigenetikken handler om hva som skjer under fosterutviklingen. Da er det nesten som om cellene går på skole. De lærer, husker og glemmer, forklarer Aasland.
Etter hvert som de blir mer spesialiserte, mister eller glemmer de evnen til å bli andre typer celler. Epigenetikken beskriver de molekylære mekanismene som gjør at den befruktede eggcellen faktisk kan gi opphav til alle kroppens forskjellige celler.
– Noen av de mest spennende epigenetiske mekanismene er i sving under fosterutviklingen, fra egg og sperm smelter sammen og danner en zygote, til vev og organer dannes. Viktige deler av forskningen handler om dette, sier Aasland.
Minihjerter og minihjerner
Stamcelleforskningen er et prakteksempel, ifølge professoren. Her klarer forskere å både avdekke og gjenskape epigenetiske prosesser.
Et gjennombrudd som skapte sjokkbølger kom i 2006. Da oppdaget den japanske forskeren Shinya Yamanaka hvordan modne og spesialiserte celler, for eksempel hudceller, ganske enkelt kan reprogrammeres på laboratoriet til å bli stamceller.
Han kalte dem induserte embryonale stamceller (iPS-celler). Dette er celler som har fått tilbake potensialet til å utvikle seg til alle ulike typer celler i kroppen. I 2012 fikk Yamanaka Nobelprisen i medisin for denne oppdagelsen.
I kjølvannet av iPS-gjennombruddet har laboratorier rundt om i verden klart å dyrke frem miniversjoner av de fleste organtyper, kalt organoider.
Dette klarer de ved å introdusere nøkkelfaktorer i cellene, som fører til at de blir omprogrammert og får tilbake stamcellenes evne til å dele seg og danne alle de forskjellige typene celler i kroppen.
– Veien disse iPS-cellene tar kan styres ved å tilsette en cocktail av vekst- og differensieringsfaktorer som introduserer de ønskede epigenetiske endringene, forklarer Aasland.
I dagens laboratorieskåler ligger alt fra minihjerter, minihjerner, minilever og i det siste også noe som ligner på embryo. Disse kalles organoider og embryoider og brukes som modeller for å forstå kroppens utvikling og dermed også epigenetikken som ligger til grunn.
Indre og ytre miljø
Kroppens eget indre miljø er altså avgjørende for styring av de epigenetiske mekanismene. Slik sett kan vi kanskje kalle mye av epigenetikken innebygd. Samtidig er det helt kunstig å skille indre og ytre miljø. Epigenetikken vår påvirkes av alt fra kjemiske stoffer til psykososialt miljø. Vi vet at det er farlig å puste inn mye eksos, at sunn mat og mosjon gjør oss friskere, og at stress kan gjøre oss syke.
– Studier av eneggede tvillinger viser oss noen av de mest slående eksemplene på hvordan dette skjer, forklarer Eskeland.
Selv om tvillingene har identiske genom, blir de nemlig ikke helt like. Ulike studier viser at forskjellene starter allerede i mors liv. Jo eldre tvillingparene blir, dess større blir forskjellene mellom dem.
– Ulikhetene i epigenetisk regulering blir også mer markante dersom tvillingene har forskjellig livsstil eller har blitt skilt fra hverandre i tidlig alder, oppsummerer Eskeland.
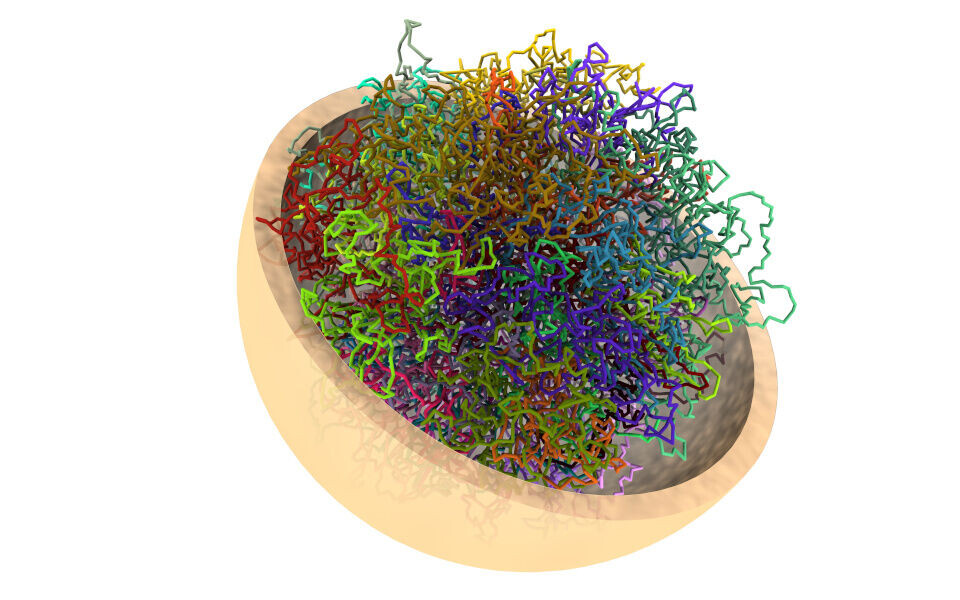
Tett eller løs pakking
For at gener skal kunne komme til uttrykk, må DNA-et være tilgjengelig for avlesing. I cellen er noen deler av DNA-et tettpakket, mens andre deler er løsere pakket. Der det er tett, kan ikke genet leses eller uttrykkes, og motsatt.
De epigenetiske merkene som påvirker pakkingen bidrar derfor til at et gen blir skrudd av, skrudd på eller dimmet.
– Det er slike mekanismer som gjør at en nervecelle for eksempel glemmer muligheten for å kunne bli en blodcelle. Vi kan si at nervecellen pakker bort genene som er spesifikke for blodceller, forklarer Aasland.
Gener lokalisert ute i periferien av cellekjernen, altså mot kanten av kjernemembranen, har en tendens til å være tettere pakket og dermed skrudd av. Inn mot midten av kjernen blir pakkingen generelt løsere og der finner vi de fleste aktive genene.
Vi begynner å forstå at genenes plassering inne i selve kjernen har stor betydning. De siste årene har forskerne også forstått at DNA-sekvensenes plassering i forhold til hverandre er avgjørende.
3D-nøste
I starten fokuserte man på at genene ble utsatt for regulering fra DNA-segmenter som ligger i nærheten på selve DNA-strengen.
– Nå har det vist seg at denne lineære tankegangen ikke er tilstrekkelig for å forklare hvordan genene reguleres, sier Aasland.
Forskere som jobber med epigenetikk ser på hele genomet i tre dimensjoner. Inne i cellekjernen ligger DNAet som et flokete nøste. Men flokene er langt fra tilfeldig organisert.
– De lange DNA-trådene er pakket hierarkisk på en slik måte at deler av genomet kan nøstes opp igjen og gjøres tilgjengelig for bruk når cellen har behov for det, sier Aasland.
En av de store nyvinningene er avdekkingen av hvordan et gen kan reguleres av epigenetiske merker på en sekvens som er langt unna på selve DNA-strengen, men likevel i nærheten i det tredimensjonale nøstet.
Det er litt det samme som skjer om du tar mobilledningen din og lager en løkke. Du får to punkter i motsatt ende av ledningen til å berøre hverandre.
Raskt oppsummert har vi altså mange ulike epigenetiske merker, vi har pakkingen av DNA og vi har 3D-organiseringen av DNA-nøstet. Vi husker også at det epigenetiske kartet er ulikt for hver eneste celletype og hvert eneste cellestadium, og dessuten blir påvirket av miljøet utenfor. Nøstet ser også annerledes ut for celler som oppstår ved sykdom som kreft.
På toppen av dette sammenligner forskerne ulike arter, blant annet for å danne seg en evolusjonær forståelse av epigenetikken. Kort fortalt er det nærmest utenkelig mye informasjon som må bearbeides for å danne et bilde av hvordan alt dette henger sammen.
– Kartleggingen av epigenomet er et helt enormt prosjekt, langt mer omfattende enn å sekvensbestemme menneskets genom. Målt i datamengde er det rett og slett vanskelig å vurdere hvor mye det er snakk om, sier Eskeland.
Stadig mer avanserte metoder
Epigenetisk forskning er et fagfelt hvor nye fremskritt kommer i et gjensidig samspill mellom utvikling av teknologi og utvikling av nye ideer og spørsmål, ifølge Aasland. Sekvenseringsteknologien har blitt mye raskere, billigere og mer presis.
– Når denne teknologien kombineres med andre metoder, kan vi uteske den epigenetiske informasjonen, sier Aasland.
I starten handlet sekvensering om å bare se på DNA-et for å studere genene. Når DNA-molekylene isoleres fra cellene, fjernes all den informative konteksten – for eksempel merkene og pakkeproteinene.
Nå kan forskerne for eksempel «fiske ut» epigenetiske merker på DNA, og deretter bruke sekvensering til å se akkurat hvor på DNA-strengen merkene sitter.
I begynnelsen måtte forskerne ha mange celler for å få nok materiale å måle med sekvenseringsteknologien. Nå er det faktisk også blitt mulig å måle mange av de epigenetiske merkene i enkeltceller.
Dette er viktig fordi lignende celletyper kan være ganske ulike. Forskerne sier at vev er heterogent.
– Dette er en fersk teknologi som åpner for helt nye måter å studere epigenetikk på. Den brukes nå veldig mye i all praktisk moderne biologi, enten det handler om å se hva som skjer når kroppen utvikler seg, når sykdom oppstår – eller når man sammenligner det epigenetiske landskapet i celler hos både mennesker og andre dyr, sier Aasland.
En annen metode handler om å bruke molekylær saks, det vil si et enzym som kutter i DNA og setter inn en kort DNA-sekvens. Saksen slipper godt til og kutter der genomet er løst pakket og genene er aktive, men ikke der det er tettpakket. Sekvensen som settes inn blir templat for DNA-sekvensering som gir informasjon om hvor enzymet har vært aktivt. Dermed kan forskerne pusle sammen et stadig bedre kart over tett og løst pakket DNA.
– Presisjonen på dette utvikles stadig, sier Aasland.
Satser på Hi-C
En av de store teknologiske nyvinningene er muligheten til å kartlegge hvilke av DNA-regionene som sitter nær hverandre i det tredimensjonale rommet inne i cellen. To DNA-segmenter langt fra hverandre på et kromosom kan være i fysisk berøring med hverandre i forbindelse med en reguleringsmekanisme.
Dette kan påvises med en metode kalt Hi-C, som måler sannsynligheten for at to steder på et kromosom, for eksempel to gener, er nær hverandre.
– Metoden fungerer ved at man først “fryser” innholdet i cellekjernen. Deretter isolerer man de DNA-segmentene som interagerer med hverandre, og sekvenserer disse, forklarer Collas.
– Her snakker vi om hundretusenvis av mulige interaksjoner, sier Aasland.
Han forbereder seg nå til å ta metoden i bruk for å forstå histonenes rolle i genreguleringen.
Collas var den første i Norge til å bruke Hi-C-metoden, blant annet til å studere hvordan 3D-genomet er koblet sammen når stamceller fra fettvev blir til forskjellige celletyper.
Eskeland satser også på Hi-C. Hun undersøker hva slags tredimensjonal feilorganisering som skjer ved utvikling av kreft.
Veldig sofistikerte datametoder trengs for å oversette alle avstandsberegningene til et 3D-kart over DNA-et, så biologene og medisinerne er avhengige av gode bioinformatikere. Eskeland sier dette er den viktigste flaskehalsen for forskningen på epigenetikk akkurat nå.
– Den virkelige utfordringen er å finne gode bioinformatikere som også har den biologiske forståelsen, sier hun.
Trenger tverrfaglighet
– Vi trenger stor regnekraft for å gjennomføre analysene, og derfor bruker vi regneklynger, forklarer Jonas Paulsen, førsteamanuensis ved Institutt for biovitenskap og tilknyttet Senter for bioinformatikk ved UiO.
Hans hovedfelt er bioinformatikk, men han har også bakgrunn i biologi. Han utvikler verktøy og programvare som tar i bruk regnekraft og algoritmer for å løse vitenskapelige problemer på epigenetikkfeltet.

– Forskernes nye verktøy genererer nemlig så store datamengder at man trenger kompetanse på informatikk for i det hele tatt å kunne analysere datasettene. Men også for å kunne utvikle tilpassede beregningsverktøy, sier Paulsen.
I Norge er det etablert et nasjonalt system for tungregning som kobler sammen servere fra ulike steder i landet, kalt UNINETT Sigma2. Dette gir norske forskere tilgang til noen av verdens kraftigste datamaskiner.
– Etter hvert som datasettene og kompleksiteten øker, blir også behovet for tverrfaglighet større. Det blir rett og slett nødvendig for at feltet skal kunne bevege seg videre, sier Paulsen.
Han jobber med Hi-C, og forklarer at arbeidet dreier seg om å få ut store matriser som forteller hvilke områder på genomet som er i kontakt, og deretter utvikle programvare med beregningsmetoder som oversetter kontaktmatrisene til modeller av genomet i 3D.
Økende kompleksitet
Ut kommer altså en modell av cellekjernen. Posisjonen til genene er kjent fra før, og dermed kan forskerne si noe om hva annet som egentlig befinner seg i nærheten og muligens påvirker genuttrykket.
– Den tredimensjonale organiseringen varierer mellom ulike celletyper. For eksempel kan en celle flytte gener fra periferien til sentrum av kjernen, for å sørge for at de kommer i et miljø hvor de oppreguleres, sier Paulsen.
Collas understreker at utviklingen innen epigenetikken har ført til at forskerne forstår mye mer, og dermed kan forklare ting de ikke kunne forklare før – for eksempel når det gjelder årsaker til sykdom.
– Samtidig har kompleksiteten gått rett i taket, og hvert nye svar utløser ti nye spørsmål, sier han.
Collas understreker at feltet er i startgropen når det gjelder avdekking av epigenetisk 3D-regulering, og at det er i ferd med å åpne seg et hav av nye forsøk og muligheter for å forstå og studere både enkeltsykommer og mekanismer på et helt grunnleggende nivå.
Enda et nivå
Det er også avdekket et annet lag med epigenetikk, på toppen av mekanismene som er koblet til DNAet og histonene. Det viser seg at også mRNA er utsatt for epigenetisk regulering. Som for histoner og DNA finnes det enzymer som setter på og tar av kjemiske merker på mRNA-molekylet. Dette påvirker hvordan informasjonen i genene brukes i praksis.

Professor Arne Klungland leder Institutt for biovitenskap ved UiO og en forskningsgruppe ved Oslo universitetssykehus (OUS). Han var en av de aller første forskerne som jobbet med dette.
– Den første artikkelen jeg var med på om dette kom i 2013. Da var det veldig lett å følge med på hva som skjedde. Nå kommer det tusen forskningsartikler om RNA-epigenetikk i året, og det er vanskelig å følge med, sier Klungland.
Instituttlederen viser til filosofen Lou Marinoffs, som formulerer det slik i boka «Philosophical Practice»:
Not only is there no end to knowing, there is no end to unknowing. For as the surface area of the sphere of reliable knowledge increases, so does that with which it interfaces, namely the unknown. Hence the more we know, the more we also know we don’t know.
Klungland ser det for seg som en lyskaster på en mørk slette.
– Et rundt felt blir opplyst. Så tar du frem en større lyskaster. Et større felt blir opplyst. Økt omkrets på det opplyste feltet gir et større grensesnitt mot mørket.
























