CRISPR
Redigerings-revolusjonen
En ny type DNA-redigering har omformet genforskningen.Kliniske forsøk på mennesker er allerede i gang i utlandet.CRISPR-Cas9 kommer til et laboratorium nær deg!
Innen genredigering representerer CRISPR-Cas9 en omveltende forenkling og forbedring. Den nye, molekylære versjonen av saks og lim er mye raskere, enklere, billigere og mer presis enn tidligere metoder.
– Dette er et fantastisk verktøy. For oss som driver med grunnforskning innen cellebiologi og proteinfunksjoner har det gjort hverdagen veldig annerledes. Nå kan vi gjøre ting som ikke var mulig før, sier senioringeniør Per Arne Aas ved Institutt for klinisk og molekylær medisin ved NTNU.
Han gjør redigeringsjobber for flere ulike forskningsprosjekter. De siste to - tre årene har han redigert genene i rundt 15 ulike cellekulturer fra mennesker, mus og rotte ved hjelp av CRISPR-Cas9. I starten handlet det om å slå ut gener, men nå handler det også om å bytte ut sekvenser.
– Med tidligere metoder var det så mye jobb å få satt inn noe på riktig sted i genomet, at det i praksis ikke var mulig. Det er fremdeles ikke trivielt, men nå går det an, sier Aas.
Tusen bibler
Menneskelig DNA er bygd opp av over tre milliarder basepar. Om de var bokstaver i en bok, ville den vært forferdelig tykk. I bibelen er det rundt tre millioner bokstaver, så vi snakker om en stabel med tusen bibler. Med CRISPR-Cas9 er det mulig å bytte ut én bestemt bokstav på én bestemt side i én av disse tusen biblene.
Da kan det kanskje høres ut som om det er mulig å fjerne eller legge til de egenskapene vi ønsker i et individ, men så langt er ikke forskerne kommet. Å lese bokstavene i et genom er langt fra det samme som å lese en bok. Baseparenes språk er ikke godt nok forstått til at bokstavrekkefølgen kan fortelle hvordan alle de molekylære prosessene i cellene fungerer.
Stadig bedre verktøy for lesing eller sekvensering av gener har riktignok stått for en revolusjon i seg selv. I dag kan man mye om funksjonene til ulike gener, og mange ulike genvarianter er kartlagt. Det er likevel ubeskrivelig mye arbeid som gjenstår før forskerne forstår i detalj hvordan alle de ulike delene av det menneskelige genom virker.

– Når det gjelder funksjonen av og interaksjonen mellom ulike proteiner og RNA i cellene, kommer vi ikke til å være ferdige på veldig lenge – selv om ting går stadig raskere, sier Aas.
Grunnforskning
Derfor er dagens viktigste anvendelsesområde for CRISPR-Cas9 nettopp innen grunnforskning. Man redigerer i gener for å lære mer om cellenes molekylære irrganger, enten det gjelder menneskelige sykdommer, planters insektforsvar eller laksens reproduksjonssystem.
Én strategi for å skaffe slik kunnskap, kan være å studere en cellekultur som har fått klipt vekk eller byttet ut en bestemt DNA-sekvens. Kanskje er det snakk om ett eller noen få basepar som er mistenkt for å forårsake sykdom. Deretter kan denne cellekulturen, eventuelt også organlignende vev, sammenlignes med celler og vev som ikke er redigert. Slik forskning fører ikke direkte til nye behandlingsmetoder, men kan legge grunnlag for ny kunnskap og nye typer medisiner.
Samtidig er allerede de første kliniske forsøkene med CRISPR-Cas9 på mennesker i gang. Kinesiske forskere var først ute i 2016, ifølge tidsskriftet Nature. De injiserte genredigerte celler i en pasient med aggressiv lungekreft, som del av et klinisk forsøk.
Siden 2009 har eldre redigeringsteknikker vært i bruk i forskning på genterapi/immunterapi mot kreft, med lovende resultater. CRISPR-Cas9 akselererer nå arbeidet for å få genredigerte celler inn på klinikkene rundt om i verden.
Det første forsøket på å redigere celler mens de er i menneskekroppen er også i ferd med å starte opp i Kina. En gelé med det nødvendige CRISPR-Cas9-maskineriet skal smøres på livmorhalsen til 60 kvinner, rapporterer New Scientist. Planen er at CRISPR-Cas9 skal ødelegge DNA fra humant papillomavirus (HPV) som er kommet seg inn i livmorhalsceller. Slikt DNA fra HPV kan forårsake kreft.
En rekke utenlandske selskaper satser stort med tanke på kommersialisering innen medisinsk behandling, og prestisjetunge, amerikanske universiteter kjemper innbitt om patentrettigheter.
Immunsystem
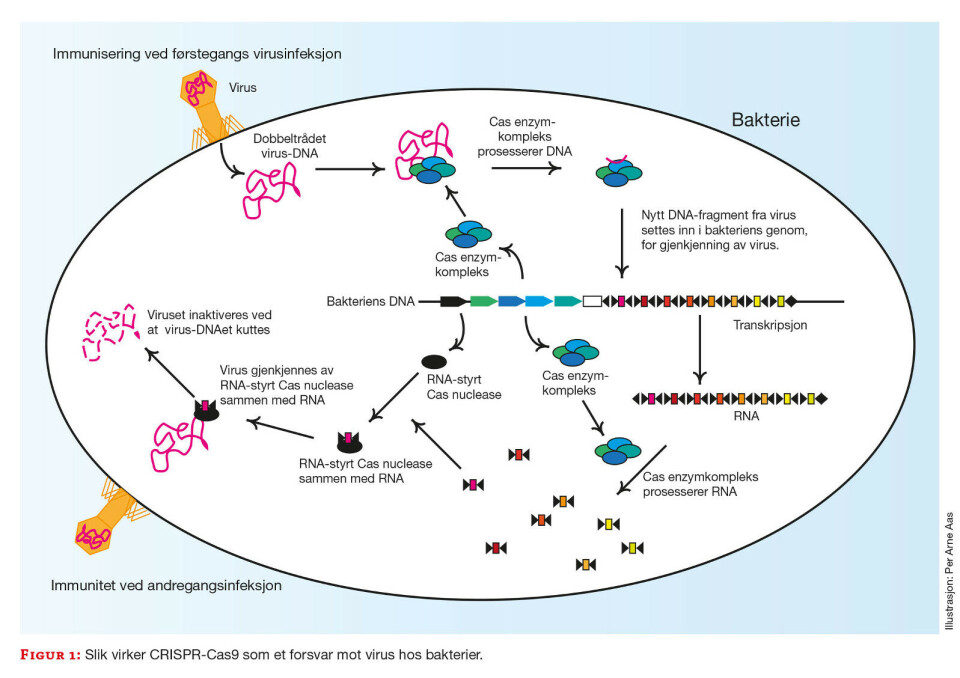
Men hva er egentlig dette nye redigeringsverktøyet med den vanskelige forkortelsen? Jo, det er en naturmetode utviklet av bakterier, som et genetisk forsvar mot virus. Mange bakterier tar nemlig opp små biter av virus-DNA i sitt eget arvestoff. Gjentagende DNA-sekvenser kalt CRISPR danner båser hvor disse bitene plasseres. RNA-transkript herfra brukes til å gjenkjenne DNA i lignende virus som angriper, nesten som en database over forbrytere.
Den andre delen av forsvarsmekanismen er et sett med enzymer kalt Cas, som kan klippe DNA. Utstyrt med guide-RNA kopiert fra forbryter-databasen, seiler Cas-enzymer ut i cella som målrettede molekylære sakser. Når et Cas-enzym kommer forbi genetisk materiale fra et virus som passer RNA-signalementet, klipper enzymet opp DNAet i angriperen. Konsekvensen er at viruset ikke klarer å replikere seg selv (figur 1).
Doudna og Charpentier
CRISPR ble først oppdaget på 1980-tallet, men da var funksjonen ukjent. I 2007 ble det vist at det var snakk om et immunsystem, men det store gjennombruddet kom i 2012. Jennifer Doudna og Emmanuelle Charpentier modifiserte Cas9 fra bakterien Streptococcus pyogenes og lanserte ideen om at et slikt Cas9 ville kunne kutte hvilken som helst DNA-sekvens om det ble programmert med riktig guide-RNA. RNA er relativt billig og enkelt å syntetisere i dag.
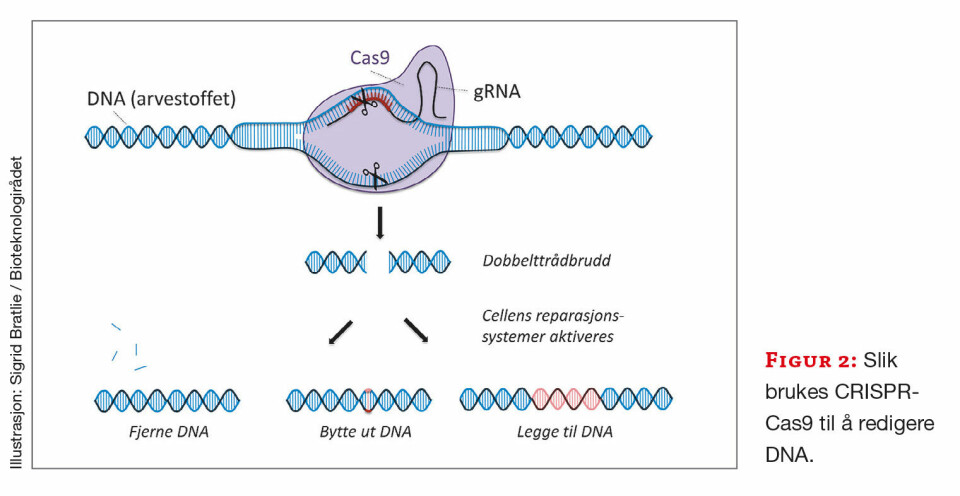
Dermed ble et nytt og kraftfullt verktøy for genredigering født. Et dobbelt kutt kan fjerne en sekvens og dermed skru av et bestemt gen i en celle. Med modifiserte versjoner av Cas9 er det også mulig å skru på gener. I tillegg brukes systemet til å sette inn nytt DNA, ved å sende inn en DNA-mal sammen med CRISPR-Cas9. Cellenes eget reparasjonssystem kobler sammen DNA-trådene igjen med utelatelser, erstatninger eller revisjoner (figur 2).
– Jeg pleier å designe mine egne guide-RNA, og bestiller dem så for rundt 600 kroner per stykk fra Kina. De kommer i posten etter en uke eller to. Deretter bruker jeg ulike metoder for å få redigeringsmaskineriet inn i celler. Fra start til slutt tar det fem - seks uker, sier Aas.
For de som ikke designer sitt eget guide-RNA, er titusenvis av sekvenser gjort åpent tilgjengelige for forskermiljøet i egne databaser.
DNA-reparasjon
Professor Magnar Bjørås er én av forskerne som sender redigeringsjobber til senioringeniør Aas. Gruppen til Bjørås jobber med å forstå kroppens vedlikehold av arvestoff og hører til ved Institutt for klinisk og molekylær medisin ved NTNU.
– Vi ser på betydningen av DNA-reparasjon og er spesielt interesserte i hvordan dette kan hindre kreftutvikling. Vi har også begynt å se mer på betydningen av DNA-reparasjon for andre sykdommer, som for eksempel nevrodegenerative og kardiovaskulære sykdommer. Dessuten ser vi på kognitiv funksjon – det vil si hvordan vedlikehold av DNA i hjernen påvirker hukommelse og læring, forteller professoren.

Bjørås fremhever at CRISPR-Cas9 har en mye høyere presisjon enn tidligere teknikker, og at det nye verktøyet gjør det mulig å redigere gener helt ned på enkeltbasenivå.
– Nå kan vi gjøre dette direkte i en menneskecelle – raskt, og med mye mindre sjanse for uønskede endringer på DNA-et, sier professoren.
Fremdeles er det mye diskusjon rundt risikoen for å få uønskede endringer med på kjøpet, men CRISPR-Cas9 blir stadig forbedret, og Bjørås ser for seg at potensialet innen helseforskning er stort.
– Blant de største. Det vil bli mulig å redigere vekk alvorlige genfeil i mennesker og ta bort genetiske sykdommer, sier han.
Kontroversielt
Her er vi ved den mest kontroversielle siden av teknologien: Muligheten for å redigere i den menneskelige arverekka.
For eksempel kan vi se for oss at det en dag blir mulig å ta bort den alvorlige, arvelige sykdommen cystisk fibrose fra embryo, enten i laboratoriene for assistert befruktning eller tidlig i mors liv. De fleste pasienter med cystisk fibrose dør av lungesvikt i ung voksen alder. Sykdomsgenet ble funnet allerede i 1989, og de mulige underliggende mutasjonene er godt kartlagt.
– Om jeg skal snakke som en mann i gata, og ikke som forsker, ønsker jeg at alvorlige, arvelige sykdommer skal kunne redigeres vekk – ut fra et rent menneskelig perspektiv. Det er snakk om sykdommer som påfører så mye smerte og lidelse, sier Bjørås.
Flere internasjonale fagmiljøer har de siste par årene uttalt at forbudet mot genetiske endringer av embryo eller kjønnsceller som kan gå i arv, bør oppheves for visse alvorlige arvelige sykdommer. Både European Society of Human Reproduction and Embryology og amerikanske National Academy of Sciences har kommet med slike anbefalinger. Ett av argumentene er at redigeringsteknologien vil bli så presis at det ikke er farlig om endringene går i arv.
Vil videreføre forbud
Da det norske Bioteknologirådet ga sitt innspill til evalueringen av Bioteknologiloven i 2015, ville det ikke åpne for slike arvelige endringer. Samtidig mente rådet at det bør være tillatt å genmodifisere kjønnsceller, og embryoer som blir til overs ved assistert befruktning. Vilkåret burde være at embryoene ødelegges etter 14 dager. Slik forskning er det åpnet for i land som Sverige og England.
– Bioteknologirådet mener foreløpig at vi ikke skal endre arverekka, men vi følger med på utviklingen, sier Sigrid Bratlie, seniorrådgiver i rådet.
Hun understreker at debatten om dette blir mer og mer aktuell etter hvert som feltet går fremover.
– Holdningene i forskningsmiljøene er i rask endring. Stadig flere mener det kan være etisk uforsvarlig å la være å redigere bort arvelige sykdommer dersom metoden er god og trygg, og ikke fører til mange utilsiktede effekter, sier Bratlie.

Helse- og omsorgsdepartementet fulgte ikke Bioteknologirådets anbefaling i stortingsmeldingen som ble lagt frem like før sommeren. Der står det at dagens forbud mot genredigering av befruktede egg bør videreføres, selv om eggene skal destrueres. «...å åpne for genmodifisering av befruktede egg vil være å krysse en etisk grense som igjen vil utfordre nye grenser som for eksempel hvor lenge man kan vente med å destruere embryoet det forskes på», skriver departementet.
Rekapitulerer sykdomsforløp
Professor Bjørås ved NTNU har altså ikke lov til å redigere genene i befruktede egg fra mennesker, men forskergruppa jobber i stedet med tilsvarende systemer.
– Vi bruker laboratoriemodeller av embryonale stamceller, såkalte induserte pluripotente stamceller, som i prinsippet kan differensieres til en hvilken som helst type celle. Vi kan ta en hudcelle og reprogrammere den til å ha egenskaper tilsvarende en embryonal stamcelle, sier Bjørås.
Han beskriver en fremtidig mulighet for å redigere vekk sykdomsfremkallende mutasjoner i slike reprogrammerte celler, og deretter injisere dem tilbake i pasienten, eller differensiere dem til mer spesialiserte celler, for eksempel leverceller eller hjerteceller – avhengig av hvor i kroppen sykdommen rammer.
– I dag snakker man også om å lage organer hvor man tar utgangspunkt i pasientens egne celler, sier Bjørås.
Foreløpig er de genredigerte cellene mest nyttige som sykdomsmodeller.
– Vi kan på en måte rekapitulere sykdomsforløpet i laboratoriet. Det er et stort fremskritt med tanke på å forstå sykdomsutvikling, og i neste omgang for å designe nye behandlingsmetoder, sier professoren.
Diagnostisk redigering
Genredigering kan også bli et viktig verktøy i diagnostikken. Inga Bjørnevoll er konstituert avdelingssjef ved Avdeling for medisinsk genetikk ved St. Olavs hospital i Trondheim, og satser på det.
– Når vi leter etter sykdomsårsaker hos pasienter med den vanlige diagnostikken, finner vi noen ganger genvarianter som vi ikke forstår betydningen av. CRISPR-Cas9 kan brukes til å lage cellemodeller og undersøke om bestemte varianter har betydning for sykdom eller ikke. Dette kan bli en del av den vanlige laboratoriediagnostikken om ikke så veldig lenge, og vil gi økt forståelse av individuelle tilfeller, sier hun.

Avdelingssjefen forteller at satsingen på å få etablert dette på sykehuset involverer et nært samarbeid med NTNU-forskere.
– Vi driver med diagnostikk, men all diagnostikk kan bevege seg over i forskning dersom vi ikke allerede sitter på kunnskapen til å forstå det vi finner, sier Bjørnevoll.
Hun tror det kommer til å bli mye mer av slik klinikknær forskning i framtida.
Førsteamanuensis Wenche Sjursen er én av forskerne Bjørnevoll samarbeider med. Hun jobber 50/50 ved NTNUs Institutt for klinisk og molekylær medisin og Medisinsk genetisk laboratorium ved St. Olavs hospital. Sjursen har bakgrunn som bioingeniør.
– Vi er i gang med å lage cellesystemer med CRISPR-Cas9, hvor vi kan gjøre funksjonelle analyser og se hvilken effekt de genetiske variantene har, sier hun.
Sjursen forteller blant annet om en familie med mye kreft over minst fire generasjoner, men hvor man ikke fant noen varianter i kjente kreftgener som ga økt kreftrisiko. Ved hjelp av ny sekvenseringsteknologi oppdaget de en ny genetisk variant som ikke var karakterisert tidligere.
– Nå etablerer vi metoder med CRISPR-Cas9 for å få undersøkt denne og andre varianter. I cellekultur kan vi sammenligne celler som ikke har en bestemt variant med celler som har den, sier Sjursen.
Om forskerne får bekreftet at de har funnet nye genvarianter som gir sykdomsrisiko, vil det gi friske familiemedlemmer en mulighet til prediktiv testing og regelmessig oppfølging for å eventuelt oppdage kreftutvikling på et tidlig stadium.

– Et mer langsiktig mål for oss er å tilføre mer kunnskap til feltet og bidra til en mer persontilpasset utvikling av nye behandlinger, sier Sjursen.
Kan bli ny diagnostisk plattform
CRISPR-Cas9 kan brukes til mer enn å redigere gener. Modifiserte varianter av systemet oppdager ørsmå mengder virus, bakterier eller mutasjoner.
Rask og billig sykdomsdiagnose ved hjelp av papirbaserte prøver som ikke krever kjøling. Det er muligheten som skisseres av forskere fra MITs Broad Institute i USA. De har utnyttet CRISPRs evne til å gjenkjenne virus-DNA og gjort det om til en teknikk for å avsløre om kroppsvæsker inneholder genetiske markører for patogener.
Forskerne har demonstrert at systemet kan finne zikavirus i blodprøver i løpet av timer, skille mellom afrikansk og amerikansk zika, oppdage spesifikke bakterietyper som E. coli, oppdage gener for antibiotikaresistens, identifisere kreftmutasjoner i DNA-fragmenter og raskt lese informasjon fra menneskegener – som for eksempel risiko for hjertesykdom fra spyttprøver. Forskningen er publisert i tidsskriftet Science, og plattformen har fått navnet SHERLOCK.
























