FAG i praksis
Bruk av allergenkomponenter i diagnostikken av allergi
Hvordan kunnskap om den molekylære strukturen til viktige allergener kan brukes i diagnostikken av allergi, med fokus på nøtter og belgfrukter.En oversikt over noen av de mest sentrale kommersielt tilgjengelige testene – og deres diagnostiske verdi.
Bruk av allergenkomponenter i diagnostikken av allergi.pdf(356 KB)
I artikkelen «Innføring i molekylær allergologi» introduserte vi sentrale begreper for forståelsen av IgE-mediert allergi. I denne artikkelen ser vi nærmere på hvordan kunnskap om den molekylære strukturen til viktige allergener kan brukes i diagnostikken av allergi, med fokus på nøtter og belgfrukter. Siden feltet er i rask utvikling, og arbeidet med å oppnå konsensus internasjonalt pågår for fullt, er det ikke mulig å gi et entydig svar på hva som er god praksis. For noen av allergenenes vedkommende er det i dag usikkert hvilke tester som gir viktig tilleggsinformasjon, og hvilke som gir informasjon som kun er av mer akademisk interesse. Vi beskriver derfor kun et situasjonsbilde, og gir en oversikt over noen av de mest sentrale kommersielt tilgjengelige testene, og hva vi med dagens kunnskap kan si om deres diagnostiske verdi.
Indikasjoner for testing av IgE mot allergenkomponenter
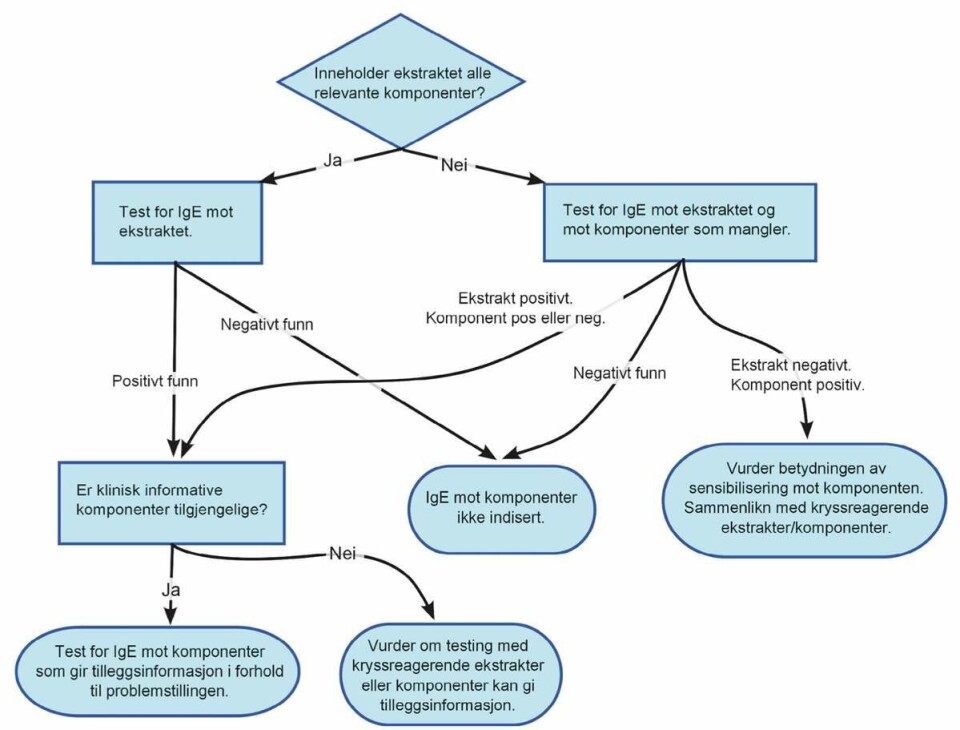
For at måling av IgE mot allergenkomponenter skal ha verdi for pasienten, må resultatet gi mer informasjon enn måling av IgE mot allergenekstrakt (se flytskjemaet i figur 1).
Her er noen eksempler på situasjoner hvor det er indikasjon for eller etterspørsel etter måling av IgE mot allergenkomponenter:
Utvelgelse av pasienter for spesifikk immunterapi (SIT)
Ved fremstilling av allergivaksiner tilstreber produsentene å lage preparater som er best mulig standardisert for hovedallergenene, det vil si de allergenene som flesteparten av pasientene har spesifikt IgE mot. Det er derfor en vanlig antagelse at pasienter som ikke er sensibilisert mot hovedallergenene, vil ha begrenset nytte av vaksinen. Pasienter med positivt funn på ekstraktet, men ikke på hovedallergenene, er ofte sensibilisert mot allergener som finnes i mange beslektede allergenkilder. Ved pollenallergi er de vanligste allergenene av denne typen profiliner, som har stor strukturlikhet i ulike plantesorter.
Kommentar: Antagelsen om at kandidater for SIT må være sensibilisert mot hovedallergener som er godt representert i vaksinen, har solid teoretisk begrunnelse. Det er likevel ikke tilstrekkelig dokumentert at pasienter som kun er sensibilisert mot ett eller noen få hovedallergener får bedre effekt av SIT, enn de som er sensibilisert mot både hovedallergener og flere mindre allergener. I tillegg er det begrenset med informasjon om sammensetningen av kommersielle vaksiner når allergenkilden inneholder mange hovedallergener (1). Det finnes i dag ingen leverandører som tilbyr skreddersydde vaksiner basert på den enkelte pasients sensibiliseringsprofil.
Identifikasjon av det primært sensibiliserende allergenet ved polysensibilisering
Ved polysensibilisering mot kryssreagerende allergener, spesielt matvareallergener, kan det være usikkert hvilke av allergenene som var de primært sensibiliserende allergenene. De primært sensibiliserende allergenene vil kunne utløse mer alvorlig allergi enn kryssreagerende allergener, som i noen tilfeller kan tolereres uten vesentlige symptomer. Men det finnes unntak. For eksempel kan pasienter med peanøttallergi samtidig være sensibilisert mot lagringsproteiner fra soya, fordi de to allergenkildene har flere strukturlike lagringsproteiner. Slike pasienter kan ha økt risiko for allergi også mot soya. Hvor høy risikoen for alvorlige reaksjoner vil kunne være, er vanskelig å forutsi ved måling av spesifikt IgE.
Et annet eksempel er bjørkepollensensibilisering, hvor det primært sensibiliserende allergenet heter Bet v 1. Allergenet tilhører gruppen PR-10 proteiner, som er strukturlike i forskjellige plantesorter, slik at pasientene kan være kryss-sensibilisert mot PR-10 proteiner fra blant annet hasselnøtter, peanøtter, soya, epler og kirsebær. PR-10 proteinene ødelegges lett ved fremstilling av allergenekstrakter. Derfor kan det være kun svake eller negative reaksjoner med de aktuelle ekstraktene hos pasienter som er sensibilisert mot kryssreagerende allergener. Noen pasienter med slike kryssreaksjoner får ubehag særlig i munnhule og svelg ved inntak av disse matvarene i rå eller lite bearbeidet form, mens de vil tåle for eksempel eplesyltetøy. Testing med allergenkomponenter kan verifisere at det foreligger sensibilisering.
Kommentar: De nevnte kryssreaksjonene er velkjente for alle som behandler pasienter med allergi, og testen tjener ikke til annet enn å forklare det pasienten visste fra før, nemlig at han eller hun får lokale reaksjoner i munnen av matvarene. Behandleren vil kunne forklare årsaken uten hjelp av tester. I sjeldne tilfeller, ved store inntak av matvarene i ubehandlet form, kan det oppstå mer alvorlige reaksjoner. I slike situasjoner vil testing med IgE mot allergenkomponenter være bedre begrunnet.
Diagnostisk og prediktiv verdi av IgE mot allergenkomponenter
For å bedømme den kliniske verdien til tester som måler IgE mot allergenkomponenter, trenger man et mest mulig objektivt mål for om den mistenkte allergenkilden utløser symptomer. «Gullstandarden» for verifisering av at en matvare er årsak til en overfølsomhetsreaksjon, kalles dobbelt blind placebokontrollert kostprovokasjonstest. Testen går ut på at den mistenkte ingrediensen inngår i en rett som tilberedes med og uten ingrediensen, med smakstilsetninger som gjør at pasienten ikke kan smake om ingrediensen er tilstede eller ikke. Positiv provokasjonstest vil si at pasienten får allergisymptomer på måltidet som inneholder den mistenkte matvaren, og kan spise det andre måltidet uten symptomer. Matvaren serveres uten at pasient eller behandler vet om den mistenkte ingrediensen inngår i måltidet.
For noen allergener er det vist at testing av IgE mot allergenkomponenter har bedre prediktiv verdi for positiv kostprovokasjonstest enn ekstraktet. Matvaren hvor dette er best dokumentert, er peanøtter. Pasienter med klar anamnese på alvorlige reaksjoner ved inntak av peanøtter, og som har høye nivåer av IgE mot det kraftigste peanøttallergenet, Ara h 2, har så stor sannsynlighet for positiv provokasjonstest at noen behandlere vil velge å avstå fra provokasjonstesten. Tilsvarende er det for hasselnøttallergenet Cor a 14, og i noe mindre grad Cor a 9, vist at påvisning av IgE mot disse allergenene har bedre prediktiv verdi for positiv provokasjonstest enn hasselnøttekstrakt (2).
Kommentar: Kunnskapen om den prediktive verdien til de nevnte allergenene, kommer i hovedsak fra pasienter som er valgt ut fordi de har hatt alvorlige allergiske reaksjoner ved inntak av peanøtter eller hasselnøtter. Vi vet mindre om hva en sensibilisering mot Ara h 2 eller Cor a 14 betyr hos en pasient hvor anamnesen er mer usikker, og hvor sensibiliseringen er påvist som ledd i en bredere utredning, eller påvist ved hjelp av testmetoder som undersøker mange allergener samtidig (multiplekstesting). I en slik situasjon kan det være større grunn til å gjennomføre en kostprovokasjon.
Testing med ekstrakter hvor viktige allergenkomponenter er underrepresentert
Det er kjent at hveteallergenet Tri a 19 er dårlig representert i hveteekstrakt fordi det har lav vannløselighet. Ved mistanke om hveteallergi bør man derfor også teste for Tri a 19. Som tidligere beskrevet, er planteproteinene i familien PR-10 dårlig representert i mange allergenekstrakter. Dette er som regel ikke et stort problem fordi allergenene vanligvis utløser milde og karakteristiske symptomer, som bør gi mistanke om bjørkepollensensibilisering. I noen situasjoner bør likevel slik testing gjøres. Dette gjelder særlig soyaallergenet Gly m 4, som kan beholde sin allergenisitet i lavprosesserte soyabaserte drikker som soyamelk og noen treningsdrikker. Ved mistanke om alvorlige reaksjoner på slike produkter, bør man måle IgE både mot soyaekstrakt og mot Gly m 4. Ved alvorlige reaksjoner etter store inntak av peanøtter, kan det være grunn til å teste også for sensibilisering mot PR-10 proteinet Ara h 8 (3).
Eksempler på allergener fra nøtter og belgfrukter
Hasselnøtt (Corylus avellana, Cor a)

Det finnes flere former for hasselnøttallergi. Påvisning av IgE mot hasselnøttallergener kan skille mellom disse. Den vanligste formen skyldes sensibilisering mot bjørkepollen. Hovedallergenet i bjørkepollen kryssreagerer med hasselallergenet Cor a 1. Dette kan føre til at pasienten reagerer med lokale symptomer i munn, nese og svelg ved inntak av hasselnøtter (4). Andre pasienter med allergiske reaksjoner mot hasselnøtt er sensibilisert mot lagringsproteiner fra hasselnøtt, Cor a 9 og Cor a 14. Dette sensibiliseringsmønsteret er knyttet til mer alvorlige allergiske reaksjoner enn de som sees ved bjørkepollenrelatert sensibilisering (5). Hos pasienter med hasselnøttallergi, har sensibilisering mot Cor a 14 høy prediktiv verdi for positivt utfall av kostprovokasjonstest med hasselnøtt. Også sensibilisering mot Cor a 9 har høyere prediktiv verdi enn sensibilisering mot ekstraktet (2). Det er per i dag ikke kjent hvor hyppig sensibilisering mot Cor a 9 og Cor a 14 forekommer i en ikke-allergisk populasjon.
Valnøtt (Juglans regia, Jug r)

Valnøttallergenet Jug r 1 og hasselnøttallergenet Cor a 14 tilhører begge familien 2S albuminer (6). Hos pasienter som er sensibilisert mot 2S-albuminet fra den ene av nøttesortene, vil det kunne være en varierende grad av sensibilisering mot 2S-albuminet fra den andre nøttesorten, avhengig av hvilke epitoper den enkelte pasientens IgE er rettet mot. Graden av kryssreaktivitet vil kunne påvises ved måling av spesifikt IgE mot Jug r 1 og Cor a 14. De praktiske konsekvensene av påvisning av kryssreaktivitet in vitro er likevel usikre.
Diagnostisk verdi: Det finnes per i dag to kommersielt tilgjengelige allergenkomponenter fra valnøtt på vår analyseplattform: Jug r 1 (lagringsprotein, 2S albumin) og Jug r 3 (LTP, lipid transfer protein). Hos pasienter med kliniske reaksjoner på valnøtt og sensibilisering mot valnøttekstrakt, vil testing for IgE mot Jug r 1 ikke gi vesentlig tilleggsinformasjon. Dette skyldes at det finnes flere viktige valnøttallergener som pasienten kan være sensibilisert mot, og som vi ikke kan teste for, for eksempel lagringsproteinene Jug r 2 og Jug r 4 (7, 8).
Pekannøtt (Carya illinoinensis, Car i)

Flere allergener fra pekannøtt er beskrevet; Car i 1, Car i 2 og Car i 4 (9). Ingen av disse er i dag kommersielt tilgjengelige for testing. Pekannøtt tilhører valnøttfamilien, og allergenene kryssreagerer med tilsvarende allergener fra valnøtt. Det er usikkert hvilken diagnostisk betydning fremtidige tester for IgE mot pekannøttallergener vil få.
Cashewnøtt (Anacardium occidentale, Ana o)

Den eneste kommersielt tilgjengelige allergenkomponenten fra cashewnøtt på vår analyseplattform er Ana o 3, et lagringsprotein. En nylig publisert artikkel rapporterer at testing for IgE mot Ana o 3, har høyere sensitivitet og spesifisitet for positiv kostprovokasjonstest hos barn med mistanke om allergi mot cashewnøtter, enn testing for IgE mot cashewnøttekstrakt (10).
Selv om Ana o 3 skal ha høy diagnostisk ytelse for cashewallergi, utelukker manglende utslag på IgE mot Ana o 3 likevel ikke cashewallergi, fordi det finnes flere andre allergener vi foreløpig ikke kan teste for, som kan ha klinisk betydning (Ana o 1, Ana o 2) (11, 12).
Pistasjnøtt (Pistacia vera, Pis v)

Det finnes per i dag ingen kommersielle tester for spesifikt IgE mot allergener fra pistasjnøtt. Allergenene Pis v 1, Pis v 2, , Pis v 3, Pis v 4 og Pis v 5 er beskrevet (13, 14). Flere av disse kryssreagerer med tilsvarende allergener fra cashew. Rapporten om høy diagnostisk ytelse for IgE mot Ana o 3 ved mistanke om cashewallergi (10), fant at Ana o 3 hadde like god diagnostisk ytelse for pistasjnøttallergi som for cashewallergi, antagelig på grunn av strukturlikhet mellom allergenene Ana o 3 og Pis v 1. Den diagnostiske betydningen til Ana o 3 ved pistasjnøttallergi vil måtte bekreftes av fremtidige studier. Det samme gjelder testing for IgE mot pistasjnøttallergener, når slike tester blir tilgjengelige.
Peanøtt (Arachis hypogaea, Ara h)

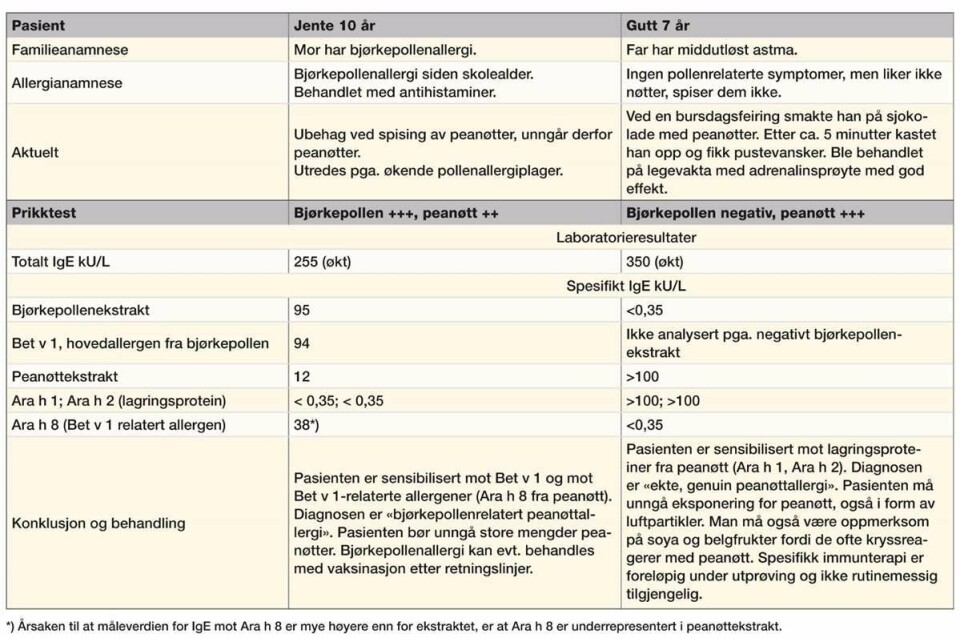
Peanøtter er den allergenkilden der det er best dokumentert at man kan differensiere mellom allergi med ulik alvorlighetsgrad, ved å analysere for IgE mot allergenkomponenter (15). Dette er illustrert i tabell 1 med to kasuistikker.
Hos pasienter med kliniske symptomer ved inntak av peanøtter, har sensibilisering mot lagringsproteinet Ara h 2 høyere prediktiv verdi for positiv kostprovokasjonstest enn sensibilisering mot peanøttekstrakt. Isolert sensibilisering mot lagringsproteinene Ara h 1 og Ara h 3 har omtrent samme prediktive verdi som sensibilisering mot peanøttekstrakt, og testing av IgE mot disse ga ikke vesentlig tilleggsinformasjon til testing av IgE mot peanøttekstrakt og mot Ara h 2. Det kom frem i en tysk studie som nylig ble publisert (2).
Det er kryssreaktivitet mellom peanøttallergenet Ara h 1 og soyaallergenet Gly m 5, og mellom peanøttallergenet Ara h 3 og soyaallergenet Gly m 6. Hos noen pasienter med kryss-sensibilisering in vitro kan det også være kliniske symptomer ved inntak av begge matvarer, men årsakssammenhengen kan likevel være usikker.
IgE fra personer som er sensibilisert mot hovedallergenet fra bjørkepollen, vil kunne kryssreagere i varierende grad med peanøttallergenet Ara h 8. Dette er forklaringen på at noen bjørkepollenallergikere reagerer med symptomer i munn, svelg og nese ved inntak av peanøtter (oralt allergisk syndrom). Bjørkepollen¬relatert peanøttsensibilisering anses å være mindre alvorlig enn sensibilisering mot lagringsproteiner (16).
Soya (Glycine max, Gly m)

Ved soyaallergi er lagringsproteinene Gly m 5 og Gly m 6 viktige allergener som er assosiert med alvorlig soyaallergi (17-19).
Allergenet Gly m 4 er beslektet med hovedallergenet i bjørkepollen, og kan hos disponerte og sensibiliserte individer gi alvorlige reaksjoner etter inntak av lavprosessert soya (soyamelk eller treningsdrikker). Anafylaksi er beskrevet (20-22). Som tidligere nevnt, gir ikke alltid sensibilisering mot Gly m 4 utslag ved testing for IgE mot soyaekstrakt.
LTP-sensibilisering
Lipid transfer proteins (LTP) er proteiner som finnes i mange matvarer fra planteriket. Sensibilisering mot LTP kan vise seg som reaksjoner på nøtter og belgfrukter, samt frukter i rosefamilien (epler, pærer, plommer, fersken, kirsebær og en rekke andre bær). Vi kan teste for IgE mot LTP fra blant annet hasselnøtt (Cor a 8), valnøtt (Jug r 3), peanøtt (Ara h 9), fersken (Pru p 3) og eple (Mal d 3).
Det har vist seg at mange pasienter i middelhavslandene som reagerer klinisk på peanøtter, har LTP-sensibilisering. I en studie viste det seg at dette var en viktigere kilde til peanøttsensibilisering i dette området enn de tradisjonelle hovedallergenene Ara h 1, Ara h 2 og Ara h 3 (23).
I World Allergy Organization’s konsensusdokument om molekylær allergologi (24) klassifiseres LTP som allergener som er forbundet med høy risiko for anafylaksi. Det konstateres likevel at det er stor variasjon mellom individer når det gjelder sammenhengen mellom sensibilisering og symptomer. Noen er asymptomatiske, andre reagerer med lokale symptomer i munn og svelg, og noen reagerer med anafylaksi. Det varierte symptombildet ved LTP-sensibilisering påpekes også av andre forfattere (23). Homologien mellom LTP fra ulike allergenkilder er moderat, slik at sensibilisering mot ett LTP ikke nødvendigvis betyr at man vil være sensibilisert mot LTP fra mange andre allergenkilder (25).
Veien videre
I den daglige laboratoriedriften har vi sett at økt kunnskap om molekylene som utløser allergi har fått praktisk betydning for diagnostikken. Vi har lært at allergenene kan deles i familier, med felles egenskaper og ofte med liknende virkninger når de utløser allergi. Hvor går så veien videre? Det er grunn til å tro at økt kunnskap om de underliggende mekanismene vil kunne gi oss nye og bedre behandlingsformer for allergi. Vi kan også vente oss utvikling av stadig flere diagnostiske tester for sensibilisering mot nye allergener. Et testprinsipp som allerede er utprøvd i kliniske studier, er bruk av biochips som tillater testing av sensibilisering mot mange allergener samtidig (multiplekstesting).
Vil vi om noen år kunne diagnostisere all allergi ved hjelp av noen mikroliter serum og en biochip? Og er det en hensiktsmessig måte å arbeide på? Antallet potensielle allergener er så stort at det er vanskelig å tenke seg at man kan føle seg trygg på at alle relevante allergener er representert på en slik chip. Innenfor overskuelig framtid tror vi derfor at allergenekstrakter fortsatt vil være et viktig diagnostisk redskap. Det samme gjelder prikktesting, som også gir behandleren muligheten til å teste direkte med allergenkilden i naturlig form. I faglige kretser foregår det en heftig diskusjon om emnet uten at man foreløpig har kommet til konsensus.
Ved tolkning av screeningundersøkelser som omfatter både mistenkte allergener og de allergenene man «får med på kjøpet» i en multipleksanalyse, må man huske at sensibilisering ikke er det samme som allergi. Ved ukritisk bruk av slik teknologi, kan man risikere at pasienter eliminerer næringsstoffer som de egentlig tåler fra kostholdet. Hos pasienter hvor mistanken om allergi er sterk, men hvor man ikke klarer å identifisere hva pasienten reagerer på, er situasjonen en annen. Da vil screening mot et stort antall allergener kunne bidra til å identifisere allergenkilden. For at resultatene skal være pålitelige, vil de likevel måtte verifiseres ved provokasjonsforsøk.
Vi bør dessuten tenke nøye gjennom om det er grunn til å bruke ressurser på å komme til en molekylær diagnose av pasientens allergi, eller om det er tilstrekkelig å kjenne allergenkilden. Vi har nevnt eksempler hvor molekylær diagnostikk kan ha praktisk betydning. I andre tilfeller får en molekylær diagnose verken behandlingsmessige eller praktiske konsekvenser for pasienten, med dagens kunnskap og behandlingsmuligheter. Hvis konsekvensen uansett blir at pasienten bør unngå allergenkilden, har det liten praktisk betydning å utføre kostbare analyser for å kartlegge det eksakte sensibiliseringsmønsteret. Hvis det derimot en dag blir mulig å skreddersy allergibehandlingen ut fra pasientens sensibiliseringsmønster, for eksempel ved bruk av skreddersydde vaksiner, vil eksakt molekylær diagnostikk bli et nødvendig verktøy for å gi optimal behandling.