FAG Essay
SARS-CoV-2; livssyklus, mutasjoner, immunreaksjoner og vaksiner
Litt over et år har gått siden SARS-CoV-2, som er årsak til sykdommen covid-19, dukket opp i Wuhan-provinsen i Kina. I mars 2020 ble pandemien erklært, og dette ble starten på en av de mest omfattende pandemiene vi har hatt i moderne tid.
Av KARL A. BROKSTAD og REBECCA J. COX
SARS-CoV-2; livssyklus, mutasjoner, immunreaksjoner og vaksiner.pdf(920 KB)
Koronavirus – taksonomi og sykdom
SARS-CoV-2 er et koronavirus. Per i dag er det cirka 50 kjente koronavirus som er isolert fra forskjellige pattedyr, fugler og amfibier. Tallet vil antagelig øke med tiden, nå som mer oppmerksomhet er rettet mot denne gruppen virus.
Koronavirus er forholdsvis store, sfæriske RNA-virus med en størrelse på 120-160 nm i diameter. Navnet kommer av at de likner kroner i elektronmikroskopet, på grunn av piggene som stikker ut av membranen.
Koronavirus er systematisert i fire slekter (alfa, beta, delta og gamma), basert på fylogenetiske forskjeller i arvematerialet (figur 1).
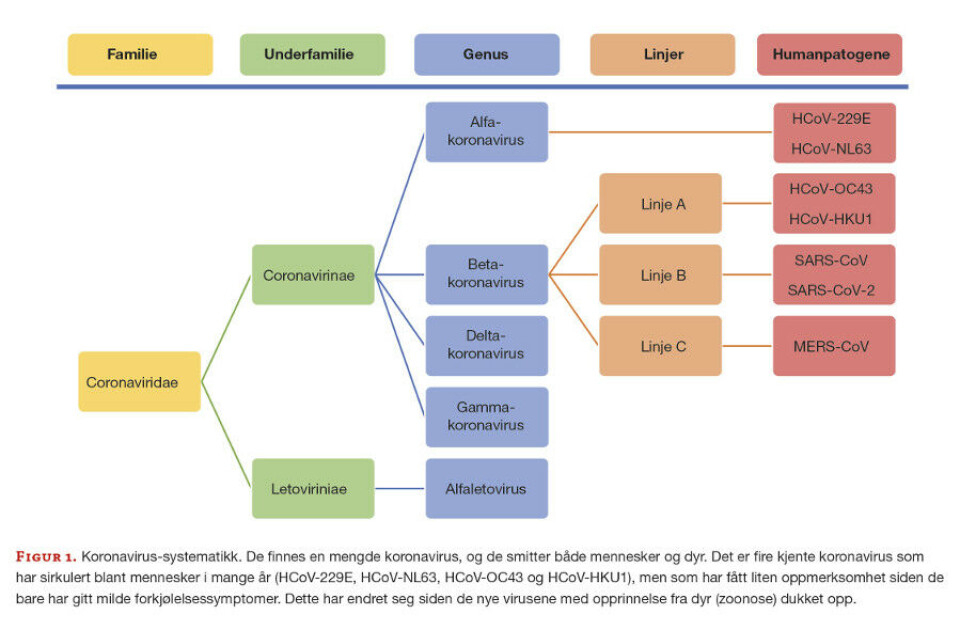
Det er også mindre forskjeller i den genetiske organiseringen av arvematerialet mellom disse gruppene. Vi finner de humanpatogene koronavirusene i alfa- og beta-koronavirusslektene. Videre er betakoronavirusene delt inn i grener som ytterligere definerer fylogenetiske ulikheter. I tillegg er SARS-CoV-2 delt inn i grupper basert på genetisk utvikling.
Vi kjenner til fire koronavirus som har sirkulert lenge hos mennesker. De gir kun milde respiratoriske symptomer, og har derfor fått liten oppmerksomhet inntil nylig. Dette gjelder alfakoronavirusstammene 229E og NL63, og betakoronavirusstammene OC43 og HKU1 (figur 1). Først med SARS-epidemien, som pågikk i 2002-2004 med episenter i Sørøst-Kina, startet forskere å studere denne virusgruppen i mer detalj. Videre brøt MERS ut i 2012, med episenter på den arabiske halvøy, og dette viruset sirkulerer fremdeles i området.
De nyere virusene gir alvorlige respiratoriske symptomer hos mennesker. SARS og MERS hadde en mortalitetsrate på henholdsvis 9,5 % og 35 %. Dødeligheten i Norge for SARS-CoV-2 ligger på cirka 1%, mens den gjennomsnittlige dødsraten på verdensbasis er på 2 %. Felles for de nye virusene er at smitten nylig er overført fra dyr til mennesker (zoonose), så de har i liten grad tilpasset seg et balansert forhold til mennesket som vert. Når vi analyserer slektskap og opprinnelse i mer detalj, så peker det mot opprinnelse fra flaggermus, selv om virusene har vært innom en annen vert før mennesker.
Oppbygging og arvemateriale
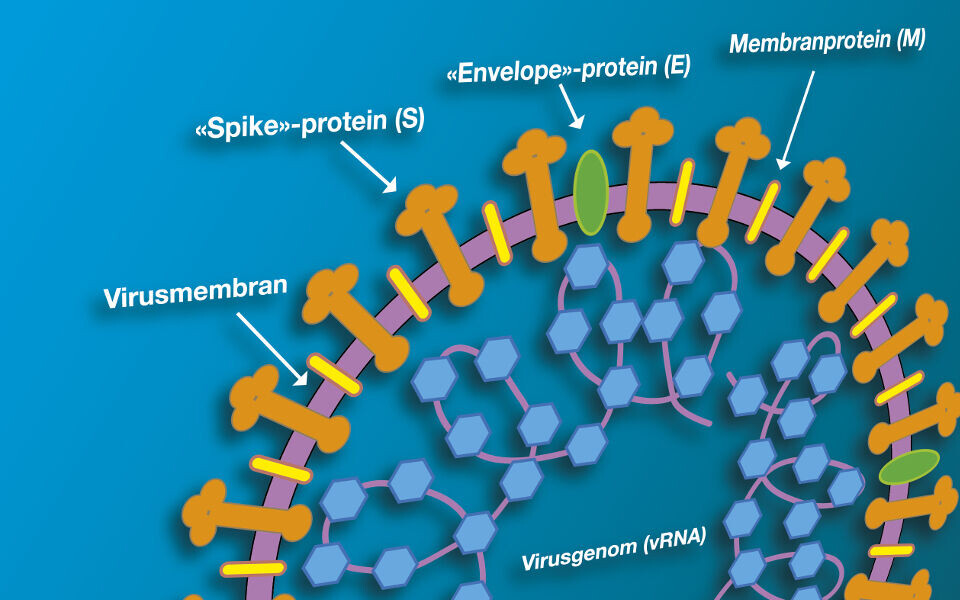
SARS-CoV-2 er sfærisk og har en membran bestående av to lag fosfolipider (figur 2). I membranen finner vi membranproteiner (M), «envelope»-proteiner (E) og «spike»-proteiner (S). Sistnevnte er viktig for virusets binding til vertscellen og infisering. Inni viruset finner vi virusgenomet (vRNA) som er kledd med nukleokapsidproteiner (N). I tillegg kan vi også finne små polymerasekompleksproteiner.
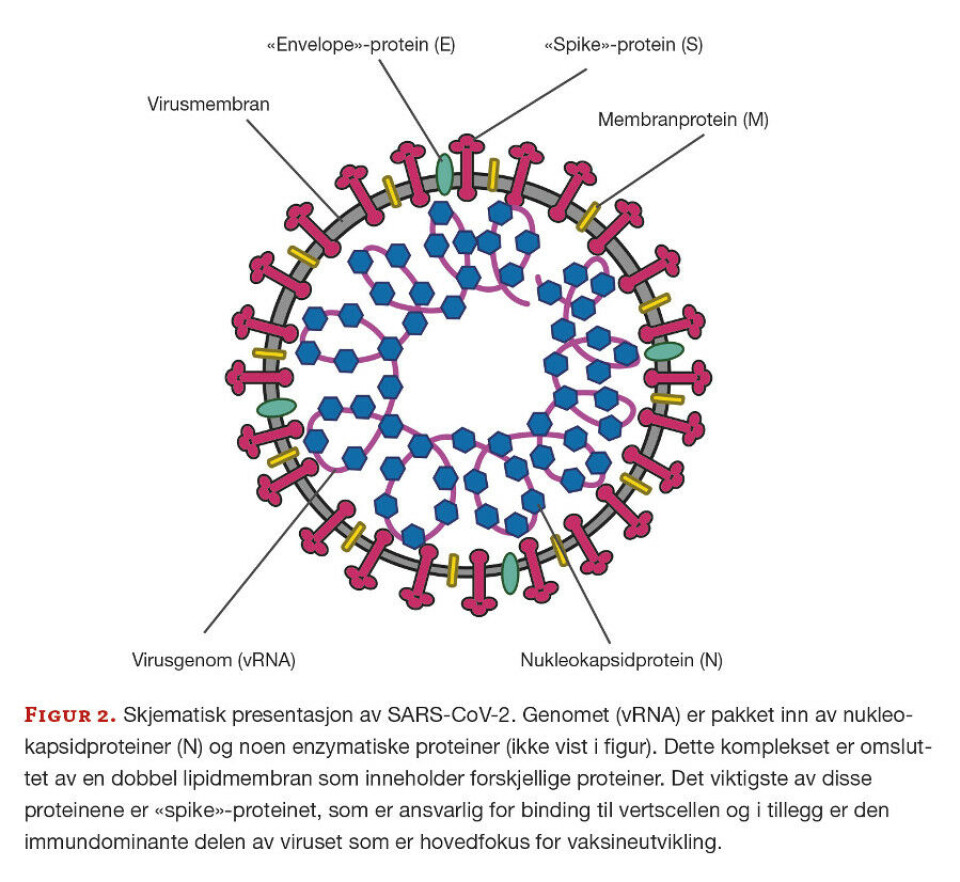
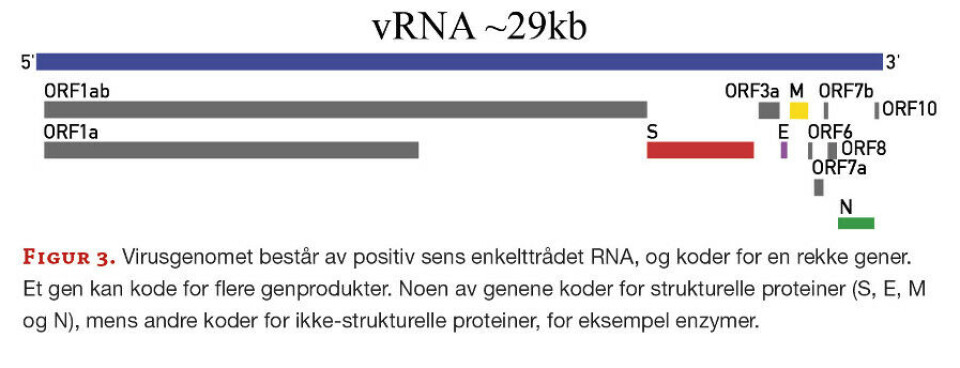
Virusets genom, på cirka 30 kb, er enkelttrådet positiv sens RNA (+) og inneholder flere gener av ulik størrelse, hvor hver av dem kan kode for et eller flere genprodukter (figur 3). I skrivende stund er det identifisert 38 virusproteiner som tilhører to grupper, ikke-strukturelle (nsp) og strukturelle proteiner. De ikke-strukturelle er primært enzymer eller andre proteiner som har med virusreplikasjonen å gjøre. De strukturelle proteinene er nukleokapsidet, membran-, «envelope»- og «spike»- proteinene. I tillegg kan også små regulatoriske ikke-kodende nukleinsyresekvenser produseres.
Livssyklus
Humane koronavirus smitter mennesker først og fremst ved dråpesmitte og kontaktsmitte, med munn og svelg som inngangsport for smitte (figur 4). I de øvre luftveiene fester SARS-CoV-2 (virionet) seg til angiotensin-converting enzyme 2 (ACE2)-reseptoren på overflaten av vertscellene. Viruset blir så internalisert i cellen ved reseptor-mediert endocytose, og deretter smelter virusmembranen sammen med den endosomale membranen, slik at virusets innhold tømmes ut i cytoplasma. Med på lasset følger også virusenzymer som er viktige i replikasjonsprosessen av viruset. Videre blir virusgenomet transkribert til enkeltrådet negativ sens RNA (-). Denne RNA-tråden blir så transkribert til mRNA (+), som fører til translasjon av de strukturelle proteinene (S, M, N, E) og andre ikke-strukturelle proteiner. I tillegg er denne tråden templat for nydannelse av vRNA (+) som skal inkorporeres i nysyntetiserte virus. Virusreplikasjonen skjer i, eller i nærheten av, endoplasmatisk retikulum (ER) og golgi-apparatet, hvor viruset pakkes og settes sammen. De nydannede virionene blir så frigjort ved eksocytose.
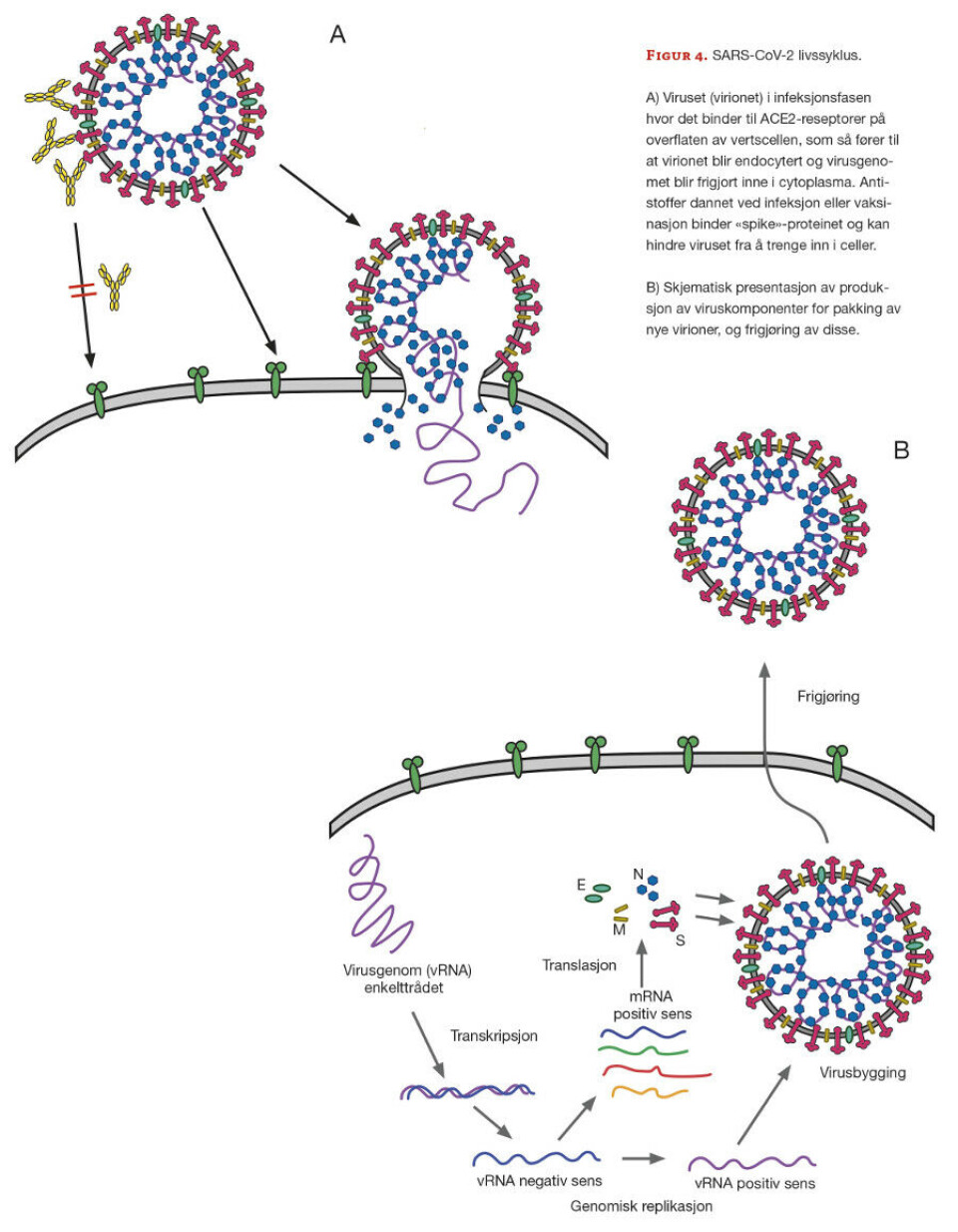
Pandemiske RNA-virus
SARS-CoV-2, influensavirus og HIV er alle RNA-virus som har forårsaket pandemier, men de er forskjellige i oppbygning og har ulike mekanismer (tabell 1).
Smittemåtene er derfor også forskjellige. Mens SARS og influensa primært smitter via øvre luftveier som dråpe- eller kontaktsmitte, overføres HIV gjennom kroppsvæskene blod, sæd, skjedesekret og morsmelk. HIV er mindre smittsomt, og kan lettere begrenses ved atferdsendring. Livssyklusen til de tre virusene er også forskjellig, de benytter ulike reseptorer på ulike celletyper (tabell 1). HIV vil ved inntrenging i cellen transportere virusgenomet inn i cellekjernen, hvor det integreres i vertens kromosom. I denne posisjonen kan viruset ligge latent eller aktiveres for å produsere nye virus.
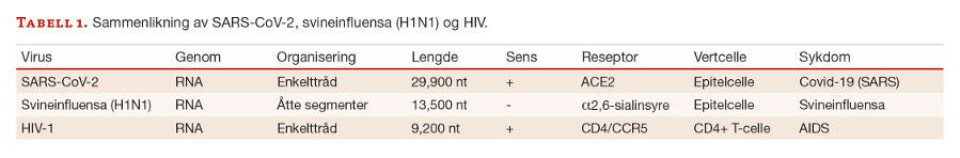
Genomsegmentene til influensaviruset transporteres også inn i cellekjernen, men opererer her aktivt som templat for nye virus. Koronaviruset er kun i cytoplasma i tilknytning til ER og Golgi-apparatet.
Virusmutasjoner
Det er et generelt mønster i mutasjonsrate hos ulike arter; større og mer komplekse organismer har lavere mutasjonsfrekvens, og det gjelder også arter med lang reproduksjonstid. RNA-virusene er små og enkle og hører til gruppen som har høyest mutasjonsfrekvens blant virusene. Hovedgrunnen til dette er at mange RNA-virus mangler korrekturlesningenzymer, slik at tilfeldige feil som oppstår under replikasjon ikke blir rettet opp.
Koronavirusene har lavere mutasjonsfrekvens enn andre RNA-virus, og det er flere grunner til dette. Koronavirus er større og mer kompliserte enn andre RNA-virus, og som nevnt tidligere påvirker dette mutasjonsfrekvensen. Men det er én ting koronavirusene har som vi ikke finner hos andre RNA-virus, og det er et rudimentært reparasjonsenzymkompleks (1). Så lenge SARS-CoV-2 ikke møter immunitet hos verten i smitteøyeblikket, blir heller ikke virusene utsatt for seleksjonspress. Til sammen fører disse faktorene til lave mutasjonsfrekvenser hos SARS-CoV-2. Når en større andel av befolkningen bygger opp immunitet, enten ved infeksjon eller vaksinasjon, vil seleksjonspresset på viruset stige og sannsynligheten for at mutasjoner oppstår vil øke.
Tross lavere mutasjonsfrekvens så foregår det en evolusjon av SARS-CoV-2, slik at det er flere grener som sirkulerer nå. Mange spør seg hva som skjer med viruset når det muterer? En mutasjon i virusgenomet kan ha flere utfall:
1. Ingen effekt
2. Uønsket effekt for viruset (negativ effekt)
a. blir mindre smittsom, eller mister evnen til å smitte
b. mister eller svekker evnen til å replikere
c. blir farligere for verten
3. Ønsket effekt for viruset (positiv effekt)
a. blir mer smittsom, spres lettere
b. blir «snillere» mot verten
Det mest sannsynlige er at mutasjoner ikke har noen åpenbar effekt. Hvis mutasjonen påvirker viruset, så er det mest sannsynlig at det går i negativ retning og påvirker smitteevne og replikasjon. Hvis vi ser på hvordan andre virus har utviklet seg over tid, så skjer det ofte en tilpasning av både virus og vert som gjør at virus blir mildere og verten lettere kan leve med viruset (darwinistisk evolusjon).
I desember 2020 ble det rapportert om en ny engelsk virusmutant (Variant of Concern 202012/01) som er antatt mer smittsom og mer aggressiv enn tidligere virus (2,3). I januar 2021 ble det rapportert om en enda mer aggressiv variant, den såkalte sør-afrikanske varianten (4). Disse antagelsene er basert på matematiske modeller, og det er kun tiden som vil vise hvor farlige disse mutantene er. Ut fra nyere studier ser det ut til at disse variantene begynner å dominere smittetilfellene her i Norge og i andre land.
Immunrespons og vaksiner
For å få langsiktig kontroll på pandemien er vaksinering den beste strategien og den mest effektive måten å bygge opp det vi kaller flokkimmunitet. Det har vært intensiv forsknings- og utviklingsaktivitet for å lage kommersielt tilgjengelige koronavaksiner siden pandemien ble erklært (5). For å få en god immunrespons som kan håndtere et smittestoff, er det viktig å involvere en så bred del av immunsystemet som mulig (6). Det viktigste målet for en slik respons er «spike»-proteinet på koronaviruset, ved at antistoffer mot dette proteinet nøytraliserer viruset (figur 5).
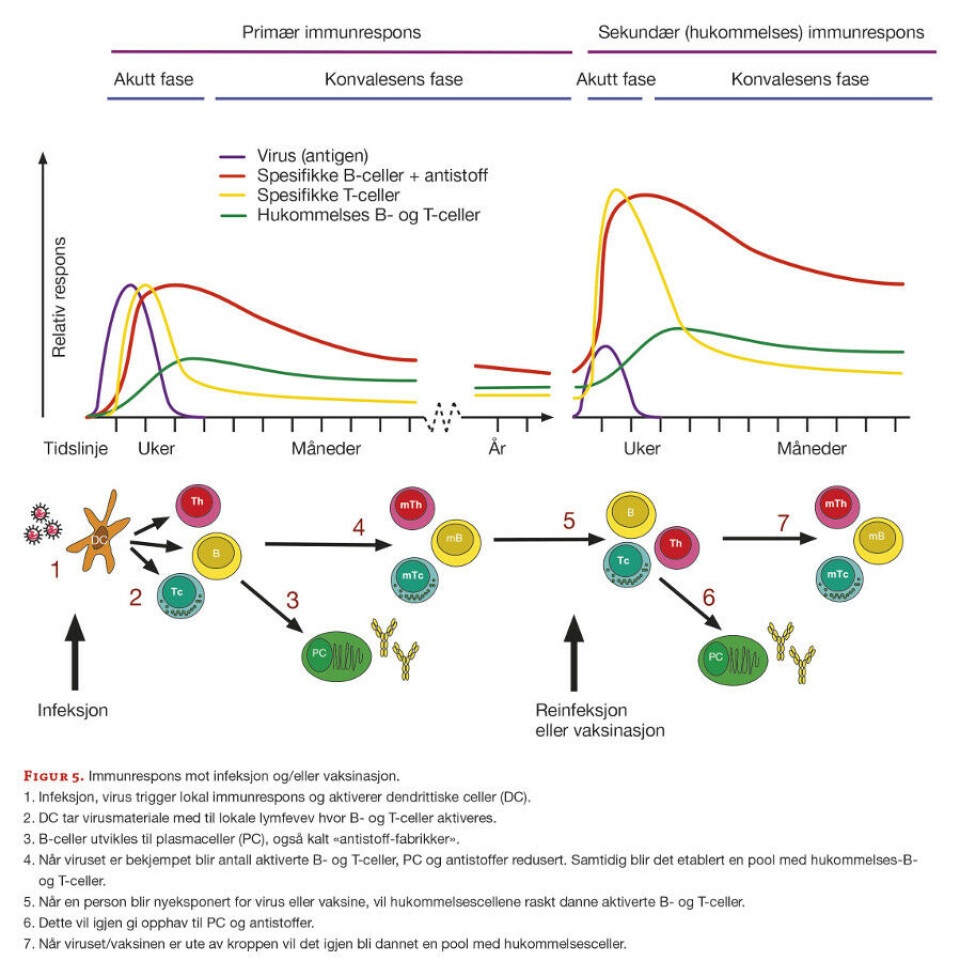
B-celler og plasmaceller er de eneste cellene i kroppen som lager antistoffer, og plasmacellene produserer antistoffer i store mengder. T-hjelpeceller (Th) har en viktig funksjon å hjelpe andre celler å bli kvitt virusinfeksjon, mens T-drepeceller (Tc) ødelegger og hjelper til med å fjerne infiserte celler. Antistoffproduksjon er viktig for kortsiktig beskyttelse, men for langtidsbeskyttelse er det nødvendig at det etableres en pool av hukommelsesceller. Lymfocytter i blodet kan veksle mellom å være aktiverte eller hukommelsesceller.
Ved førstegangseksponering for et virus, vil det ta litt lengre tid å få opp produksjonen av spesifikke antistoffer og T-celler som bidrar i bekjempelse av infeksjonen og oppbygging av immunitet. Ved ny eksponering for viruset, vil det ta kortere tid og gi sterkere reaksjon på grunn av hukommelsescellene.
I dag er det mellom 100 og 200 vaksiner i utvikling (7-9). Mange av disse vil aldri nå markedet, slik at det bare er en håndfull som er relevante for oss. Vaksinene er basert på forskjellige teknologier.
Kina har utviklet tradisjonelle vaksiner som består av helt inaktivert virus (Sinovac og Sinopharm), og disse er godkjent i Kina, Brasil og noen land i Midtøsten.
Oxford/AstraZeneca (England/Sverige) og Gamaleyainstituttet i Russland (Sputnik V) har basert sine vaksiner på rekombinant teknologi, hvor genet for «spike»-proteinet er klonet inn i inaktiverte adenovirus. Gamaleya-vaksinen er godkjent i Russland og Saudi Arabia, mens Oxford/AstraZeneca-vaksinen er i skrivende stund godkjent i Storbritannia, EU og andre land. Både de inaktiverte og rekombinante vaksinene baserer seg på at proteiner, og da særlig «spike»-proteinet (antigen), som blir injisert subkutant eller intramuskulært, hvor det kommer i kontakt med og aktiverer immunsystemet.
Moderna (USA) og Pfizer-BioNTech (USA/Tyskland) har utviklet vaksiner som består av mRNA som koder for «spike»-proteinet, pakket inn i lipidnanopartikler. Vaksinen administreres intramuskulært, hvor vaksinepartiklene blir endocytert av celler i nærheten. Når partiklene kommer inn i cellen blir de avkledd og mRNA blir frigitt til cytoplasma og transportert til ribosomene, hvor det blir translatert. mRNA-tråden er modifisert slik at «spike»-proteinet som blir syntetisert blir skilt ut av cellen og der aktiverer immunsystemet.
mRNA-vaksiner er en helt ny og uprøvd strategi i storskala på mennesker. Det må presiseres at alle vaksiner blir grundig testet før de blir godkjent og tatt i bruk, og mRNA-vaksinene ser ut til å gi god beskyttelse. Både Moderna- og Pfizer-BioNTech-vaksinene er godkjent i USA, EU, Storbritannia og andre land.
Oppsummering
Under den pågående pandemien har vi lært mye, men også gjort noen dyrekjøpte erfaringer. De landene som valgte å holde hjulene i gang for å redde økonomien har alle funnet ut at dette kun har gitt kortsiktig gevinst. Viruset har slått tilbake med høyere dødelighet og belastning på helsesystemet, og den økonomiske gevinsten har blitt vasket vekk. Landene som har kommet best ut av pandemien er de som har tatt de mest drastiske grepene for å hindre smittespredning, for eksempel Kina.
Men det er nå lys i tunellen. Farmasøytiske firmaer produserer vaksiner på høygir og mange land har kommet godt i gang med massevaksinering av befolkningen (10). Vaksineringsgraden er i skrivende stund (februar 2021) på 65% i Israel, 44% i De forente arabiske emirater, 19% i Storbritannia, 13 % i USA og 4% i EU. Norge ligger på nivå med EU i vaksineringsgrad.
Vi får håpe at massevaksineringen virker som forventet, at vi får bygget opp flokkimmuniteten og kan se frem mot en mer normal hverdag uten alle restriksjonene som vi har nå.






















