FAG i praksis
Clostridium difficile i sykehus – behov for økt oppmerksomhet?
På St. Olavs Hospital gjøres ribotyping av bakterien Clostridium difficile for å overvåke sykehusinfeksjoner og spore utbrudd. På grunn av nye hypervirulente stammer er dette viktigere enn noen gang.
Bakterien Clostridium difficile er den vanligste årsaken til antibiotikaassosiert diaré. Bakterien kan gi sykehusinfeksjon, det vil si en infeksjon ervervet under opphold på sykehus. C. difficile er en sporedannende anaerob gram positiv stavbakterie. Sporene er svært robuste og kan overleve i ulike miljøer i flere måneder. Dette kan gjøre det vanskelig å bli kvitt bakterien i for eksempel sykehusmiljøer (1).
Både voksne og barn kan få en C. difficile-infeksjon (CDI) når de er innlagt på sykehus. Når pasienter eksponeres for et miljø der C. difficile-sporer er vanlig, kan de koloniseres gjennom fekaloral smitte. Den aller første betingelsen for at en infeksjon skal etableres, er en forstyrrelse av den normale tarmfloraen. Tarmfloraen fungerer normalt som en koloniseringsbarriere som beskytter mot CDI. Denne barrieren svekkes når floraen er forstyrret. Antibiotikabehandling er den viktigste årsaken til forstyrrelse av tarmfloraen. Andre forhold som kan endre denne floraen er kjemoterapi eller syrenøytraliserende behandling. Det er en stor utfordring for smittevernet i sykehus at innlagte pasienter med diaré raskt kan forurense omgivelsene med sporer og dermed skape et potensial for et sykehusutbrudd (figur 1) (1-3). Hos innlagte pasienter med mistenkt eller påvist CDI anbefales isolasjon inntil de er symptomfrie (4). For noen pasienter kan dette innebære isolasjon over lengre tid. Sporer fra C. difficile lar seg ikke fjerne med alkoholbaserte desinfeksjonsmidler. Det er derfor viktig å bruke desinfeksjonsmiddel som for eksempel PeraSafe for å kvitte seg med eventuelle sporer i miljøet.
Infeksjon med C. difficile kan gi symptomer som diaré, magesmerter og feber. Symptomene er vanligvis milde og kortvarige, men infeksjonen kan utvikle seg til alvorlig pseudomembranøs ulcerøs kolitt og i sjeldne tilfeller den alvorlige komplikasjonen toksisk megakolon. Personer som har en normal immunrespons mot C. difficile-toksiner er mindre utsatt for CDI (figur 1). Nyfødte som ennå ikke har en fullt utviklet tarmflora, er svært ofte kolonisert av C. difficile, men forblir asymptomatiske i de fleste tilfeller. Årsaken er at de ikke har utviklet spesifikke reseptorer for toksinet i tarmcellene (5).
Ved kolonisering produserer C. difficile to toksiner som er de viktigste virulensfaktorene, vanligvis kalt toksin A (TcdA) og toksin B (TcdB). TcdA er et enterotoksin som opprinnelig var antatt å være nødvendig for virulens. Etter hvert er det imidlertid funnet at enkelte TcdB positive stammer som manglet TcdA har vært årsak til utbrudd av alvorlig CDI. TcdB er et cytotoksin som har vist seg å være 100 til 1000 ganger mer toksisk enn TcdA i enkelte typer cellekultur. Det er derfor sannsynlig at både TcdA og TcdB kan være av betydning for bakteriens virulens. C. difficile-stammer som ikke produserer toksiner anses ikke å være patogene (6).
Økning i antall tilfeller
Siden år 2000 har antallet CDI økt i USA, Canada og enkelte europeiske land. Mellom 2002 og 2005 ble en epidemi av CDI identifisert i Canada (7). Ved hjelp av molekylære typingsmetoder ble den skyldige organismen identifisert til å være en stamme av C. difficile kalt PCR ribotype 027 eller Nord-Amerikansk pulsfelt type 1 (NAP1). Det er rapportert flere tilfeller av denne stammen i ulike land over hele verden. Stammen har vært forbundet med regionale utbrudd av CDI og alvorlig kolitt som i verste fall har vært dødelig. Denne stammen har en mutasjon i et regulatorisk gen som forårsaker hyperproduksjon av toksin (8). I Europa ble PCR ribotype 027 først rapportert i England i 2005 og kort tid etterpå i Nederland (9). Senere har epidemier av CDI forårsaket av PCR ribotype 027 blitt oppdaget på sykehus i mange europeiske land. Det er derfor behov for økt oppmerksomhet i laboratoriet for å kartlegge hvilke typer som sirkulerer. Det er også stor variasjon i de europeiske landene på hvor mye oppmerksomhet denne infeksjonen får. Det er også forskjeller i diagnostiske prosedyrer på sykehus, typingsmetoder og nasjonal overvåking.
Laboratoriediagnostikk
Ved St. Olavs Hospital er laboratoriediagnostikk av CDI basert på PCR-påvisning, samt dyrkning av PCR- positive prøver. Alle prøver med mistanke om CDI analyseres med en in-house PCR for deteksjon av tcdB, genet som koder for toksin B. Alle prøver med PCR-funn av tcdB bekreftes med anaerob dyrkning på Fastidious Anaerob agar (FAA) og cykloserin-cefoxitin-fruktose-agar (CCFA-skål m /metronidazol 5 mikrogram). I tillegg til påvisning gjør St. Olavs Hospital rutinemessig genotyping av alle av C. difficile-isolater.
Ribotyping
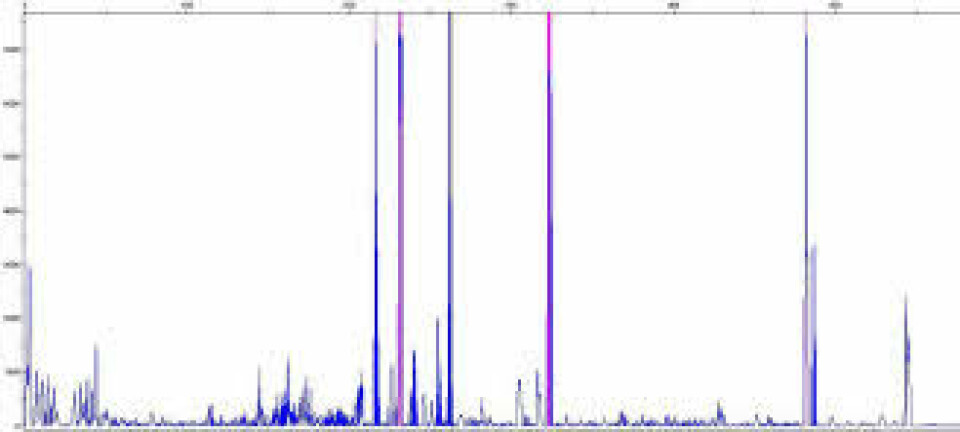
Ribotyping er en genotypingsmetode som baserer seg på størrelsesvariasjon i området mellom genet som koder for 16S og genet som koder for 23S. Mellom disse finnes et ikke-kodende område som varierer i lengde mellom ulike operoner (figur 2). Et operon er et kompleks av bakteriens DNA hvor genene kontrolleres av et felles regulatorområde. 16S-, 23S- og 5S rRNA-gener er organisert i RNA-operoner hos C. difficile. Hver enkelt bakterie har flere kopier av dette operonet i sitt genom, og det er dette som utnyttes når man ribotyper bakterien. Primerne er rettet mot siste del av 16S-genet og første del av 23S-genet, fordi dette er konserverte områder. Størrelsen på PCR produktene vil avhenge av lengden på området mellom primerne, vanligvis mellom 200 og 900 basepar. Disse separeres ved gelelektroforese og synliggjøres med fluorescens. PCR-produkter med ulik størrelse utgjør et mønster, et såkalt ”fingerprint”.
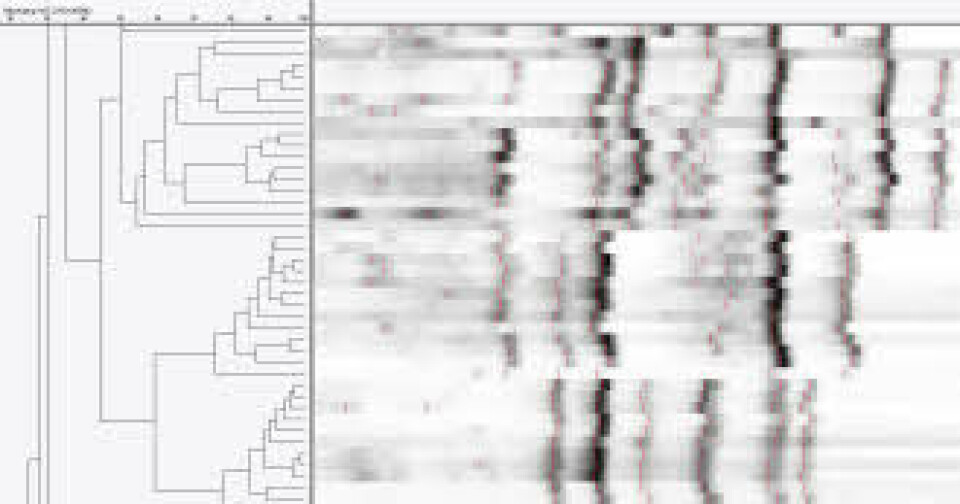
Hvert unike ”fingerprint” definerer en ribotype. Det er til nå internasjonalt beskrevet og gitt navn til over 400 ulike ribotyper. ”Fingerprintene” fra de ulike bakteriestammene sammenlignes med kjente ribotyper i et panel internasjonale prototypestammer. Denne epidemiologiske typingsmetoden er et viktig verktøy i overvåkingen av C. difficile og kan brukes i sporing av utbrudd (10, 11). Metoden har vært brukt rutinemessig på St. Olavs Hospital siden 2008. Oslo universitetssykehus (OUS), Rikshodpitalet, er referanselaboratorium for C. difficile og utfører PCR ribotyping samt andre metoder for karakterisering av bakterien.
På St. Olavs Hospital blir positive prøver dyrket på FAA og en koloni blir kokelysert i ekstraksjonsbuffer. Lysatet blir analysert ved hjelp av konvensjonell PCR og PCR-produktene blir analysert med Agilent Bioanalyzer DNA 1000 kit (Agilent technologies). Dette er et instrument som separerer og detekterer PCR-produkter basert på størrelse og framstiller resultatet automatisk. For å få en mer presis bestemmelse av størrelsen på PCR-produktene er metoden videreutviklet til avlesning ved hjelp av kapillær gelelektroforese med fragmentseparasjon på ABI 3130xL Genetic Analyzer (Applied Biosystems®). Denne metoden avhenger av fluorescensmerkede primere som detekteres i instrumentet og gjenspeiler den nøyaktige størrelsen til hvert PCR-produkt (figur 3). De samme ”fingerprintene” som beskrevet over kan kartlegges enda mer nøyaktig med denne formen for fragmentanalyse.
Overvåkning
En kartlegging av de ulike ribotypene er nyttig for å oppdage eventuelle utbrudd og forøvrig forstå spredningen av C. difficile. I tillegg er visse ribotyper forbundet med en høyere risiko for alvorlig eller komplisert CDI. Fordelingen av ribotyper kan derfor gi viktig informasjon. I England og Nederland fikk de bedre kontroll over epidemien av C. difficile PCR ribotype 027 etter at ribotyping ble gjennomført nasjonalt, og man så også en markert reduksjon i forekomst og dødelighet av CDI (9, 12).
European Clostridium difficile-infection surveillance network (ECDIS-net) er etablert for å
øke deteksjonen og overvåkingen av CDI i Europa. Det er en tverrfaglig gruppe av forskere som arbeider i samarbeid med nasjonale folkehelseinstitutter. Prosjektet har som mål å etablere en europeisk nomenklatur for C. difficile ribotyper, lage en referansesamling og database av C. difficile-stammer og utvikle en europeisk overvåkingsprotokoll for CDI (http://www.ecdisnet.eu).
St. Olavs Hospital og OUS Rikshospitalet har i samarbeid med Folkehelseinstituttet deltatt i en pilotstudie for overvåking der antall tilfeller av CDI ble rapportert i en tre-månedersperiode. Et utvalg av stammer diagnostisert i denne perioden ble sendt til Nederland for validering av lokal ribotypingsmetode (figur 4). St. Olavs Hospital, OUS, Rikshospitalet og Bærum sykehus deltok i en lignende europeisk multisenterstudie i 2008.
Studien som ble gjennomført sommeren 2013 viste at 65 % av innlagte pasienter på St. Olavs Hospital som fikk påvist toksinproduserende C. difficile i fæces, hadde en sykehuservervet infeksjon. 30 % av pasientene opplevde å få residiv av CDI og hadde vedvarende symptomer i flere måneder. Studien bekreftet at de fleste sykehuservervede CDI kommer som en følge av antibiotikabehandling (upublisert materiale).
Funn av toksinproduserende C. difficile ble gjort meldepliktig til Meldesystem for smittsomme sykdommer (gruppe C, MSIS) fra 1. juli 2012.
Takk
Metoden for PCR ribotyping ble innledningsvis testet ut av bioingeniørstudentene Camilla Olaisen og Silje Mari Nilsen Reinfjell som en bacheloroppgave: «PCR Ribotyping av Clostridium difficile».



























