FAG i praksis
TROMBOCYTTER, sensitive celler som redder liv
Trombocyttkonsentrater til transfusjon gir blodbankene store utfordringer. Kort holdbarhet, uheldige lagringsendringer og fare for bakterievekst gjør produktene svært sensitive.
TROMBOCYTTER, sensitive celler som redder liv.pdf(416 KB)
Trombocyttenes (TRC) primære funksjon er å hindre eller stanse blødning og støtte vaskulær integritet. De fleste TRC-transfusjoner gis profylaktisk for å redusere risiko for spontane blødninger hos pasienter med hematologiske tilstander. Terapeutiske TRC-transfusjoner gis for å kontrollere aktive blødningsepisoder i forbindelse med traumer og kirurgi. Trombocytter er sensitive celler som krever spesielle lagringsforhold ved 20 ± 2⁰C. Holdbarheten er begrenset til fem - syv døgn på grunn av uheldige lagringsendringer, faren for bakterievekst og infeksjonsrisiko.
Transfusjon av TRC kan føre til uheldige reaksjoner, for eksempel allergiske og febrile nonhemolytiske transfusjonsreaksjoner, transfusjonsrelatert sepsis (TRS), transfusjonsassosiert sirkulatorisk overbelastning, transfusjonsrelatert immunmodulering (TRIM), transfusjonsrelatert akutt lungeskade (TRALI) og alloimmunisering.

Et stadig økende behov for TRC-konsentrater (TRC-K) gir blodbankene store utfordringer. I denne artikkelen presenteres fire studier som er utført ved OUS Ullevål. Hensikten med studiene har vært optimalisering av TRC-kvaliteten i konsentrater og forsøk på å løse noen av de nevnte utfordringene.
Fakta om trombocytter
TRC er de minste cellene i blodet (1) og dannes hovedsakelig i benmargen ved avsnøring fra megakaryocyttenes cytoplasma. Prosessen reguleres av hormonet thrombopoietin, og en enkelt megakaryocytt kan avsnøre 1000 - 3000 TRC (2-3). Megakaryocytter utvikles fra hematopoietiske stamceller, og cytokiner og vekstfaktorer påvirker modningen (4). Et voksent menneske produserer 1 × 1011 TRC daglig, og vanlig konsentrasjon i blodet er 150 - 400 × 109/L (3).
De kjerneløse TRC har ikke genomisk DNA, men i cytosol fins mRNA og i tillegg mitokondrier som inneholder små mengder mitokondrielt DNA. TRC er i stand til å syntetisere protein. Cytoskjelettet regulerer cellestrukturen, og reseptorer på TRC-overflaten fungerer som kontakt til andre celler, skadet endotel og miljøet rundt. Cytoplasmaet inneholder tre typer granula; alfa-granula, dense bodies og lysosomer, som alle inneholder bioaktive substanser.
In vivo sirkulerer TRC hvilende og inaktive i ni til ti dager, programmerte til øyeblikkelig aktivering ved stimuli. Når en skade oppdages i endotelet, settes en kaskade av prosesser i gang: TRC aktiveres umiddelbart, adhererer til skadestedet, endrer form, utskiller bioaktive substanser fra granula og former aggregater. Koagulasjonsfaktor V (fra plasma og α-granula) vil sammen med ulike enzymkomplekser akselerere faktor X og protrombinaktivering. Trombin dannes, og medfører at fibrinogen omdannes til fibrin som stabiliserer TRC-pluggen, og blødningen begrenses (5).
Prosessering av trombocyttkonsentrater
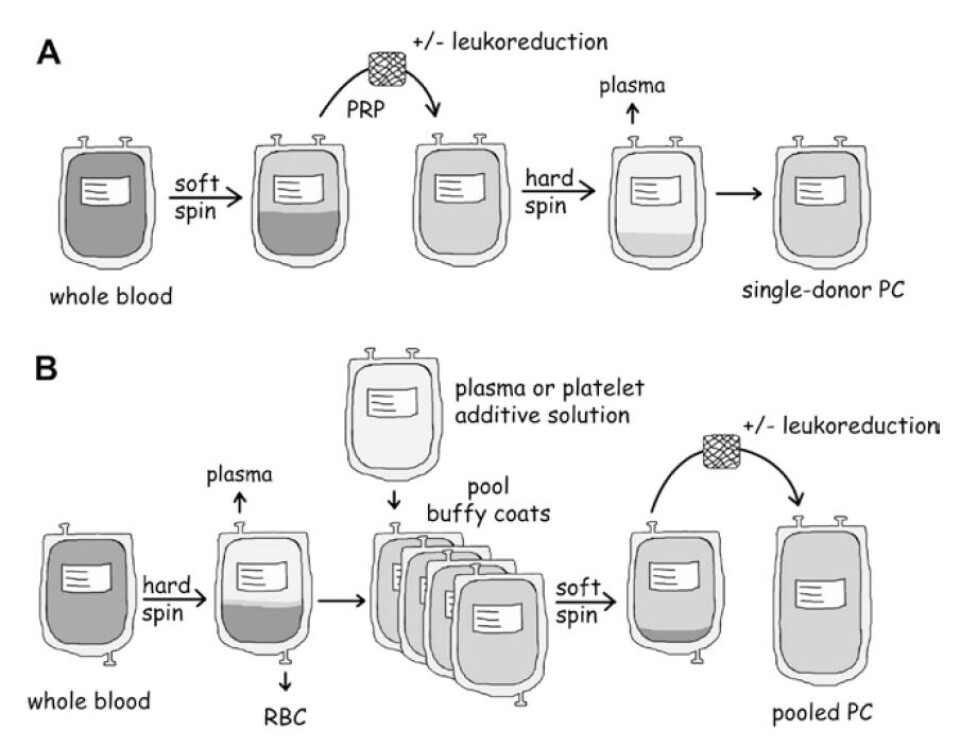
TRC-K kan prosesseres på flere måter: Fra fullblod fra en enkelt giver med PRP (platerikt plasma)-metoden (figur 1 A (6)), eller med buffycoat (BC)-metoden (figur 1 B (6)). Produksjon av TRC-K fra BC kan også utføres med automatisert utstyr, hvor et antall BC pakkes i spesielle sentrifuger og prosesseres til det ferdige sluttproduktet, et leukocyttfiltrert TRC-K.
Alternativt kan TRC tappes fra en enkelt giver ved hjelp av automatisert celle-separasjonsutstyr. Donor stikkes og blodet antikoaguleres og passerer inn i en aferesemaskin hvor TRC høstes, mens erytrocyttene returneres til donor. Uavhengig av produksjonsmetoden er sentrifugering den grunnleggende metoden for isolering av TRC. Forskjellene i sentrifugeringen utsetter TRC for ulike nivå av stress. TRC oppbevares i plasma eller en blanding av plasma og TRC-oppbevaringsløsning (PAS). Næringsstoffer for TRC fins i plasma og/eller i PAS, de viktigste komponentene er glukose og acetat.
For å redusere uønskede reaksjoner på leukocytter og leukocyttderivater, er det i Norge krav om universell leukocyttfiltrering av alle celleholdige blodprodukter til transfusjon.
Endringer ved oppbevaring av trombocytter
TRC aktiveres raskt når de eksponeres for fysiske stimuli. In vitro aktivering må begrenses slik at TRC har størst mulig aktiveringspotensial når de transfunderes og skal fungere i hemostasen.
Under tapping og lagring endres temperaturen fra 37⁰C til 22⁰C, dermed endres TRC-metabolismen og aldringen utsettes. Samtidig eksponeres TRC for fremmede overflater, metallkanyle, plastposer, syntetiske filtre og de gjennomgår en tøff behandling ved sentrifugering. Dette fremkaller mekanisk stress som kan føre til aktivering. I tillegg starter prosessen «The platelet storage lesion» (PSL), som er en samlebetegnelse for de morfologiske, biokjemiske og funksjonelle forandringene som skjer under lagring av TRC. PSL inkluderer følgende: adhesjon, aggregering, degranulering, formforandring, økt overflateuttrykk av phosphatidylserin, akkumulering av bioaktive substanser, utskillelse av mikropartikler og mitokondrieforandringer. Forandringene kan føre til at TRCs hemostatiske kapasitet nedsettes og at cytokiner, vekstfaktorer og lipider akkumuleres i konsentratet, noe som kan ha uheldige virkninger på resipienten.
Optimale lagringsforhold
TRC må lagres under forhold som sikrer at viabiliteten og den hemostatiske aktiviteten bevares optimalt. Oppbevaringsposene må være gasspermeable, og produktene skal vippes forsiktig og horisontalt for å sikre utveksling av O2 og CO2. Optimal konsentrasjon av TRC i produktet er <1500 × 109/L, pH skal være mellom 6,4 og 7,4 og temperaturen skal holdes på 22 ± 2˚C. TRC-K kan lagres i fem til syv døgn (syv døgn for produkter som overvåkes for bakterievekst eller har gjennomgått fotokjemisk patogen-reduksjonsbehandling).
Kvalitetskontroller
Kvalitetskontroller og smittetester utføres ved produksjon av TRC-K i henhold til Europarådets retningslinjer (7). Før utlevering til pasienten er den siste evalueringen av TRC-K foreløpig begrenset til kontroll av swirlingfenomenet. Normal energimetabolisme og opprettholdelse av TRCs diskoide form vil gi TRC-K et skinnende, marmorert utseende ved lysbrytning, dette kalles swirling (8). Manglende swirling fører til kassasjon.
Effekt av trombocyttransfusjon
Både produksjonsprosessen, utstyret, eventuell etterbehandling og lagringsendringer påvirker TRC-funksjonen, men også pasientens tilstand, eventuell feber, diagnose og medisinering kan påvirke TRC.
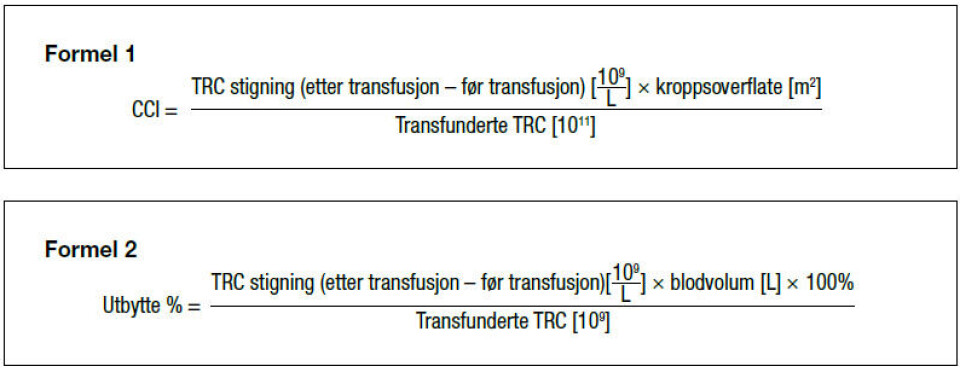
Effekten av en TRC-transfusjon ble tidligere målt med blødningstid, men metoden er uspesifikk, lite reproduserbar og vanskelig å standardisere. Blødningsepisoder kan graderes ut fra WHOs skala (9) og transfusjonsintervaller kan registreres. I store studier kalkuleres ofte «corrected count increment» (CCI) (10), som er den forventede stigning etter transfusjon av en bestemt mengde TRC.
Resultatet avhenger dog av prøvetakingstidspunktet etter transfusjonen og pasientens blodvolum (se formel 1). Kriterier for en vellykket TRC-transfusjon er CCI 1 time >7,5 eller CCI 24 timer >4,5.
Utbytte % er andelen av transfunderte TRC som er til stede i resipientens sirkulasjon på et gitt tidspunkt og kan kalkuleres (10) (se formel 2).
Overlevelse måles i dager eller timer, og er den perioden hvor transfunderte TRC kan påvises i resipientens sirkulasjon.
TRC-studier gjennomført ved OUS, Ullevål
Ved Avdeling for immunologi og transfusjonsmedisin, OUS, Ullevål, har vi de siste årene gjennomført fire større studier av TRC. Formålet var in vitro karakterisering og evaluering av TRC-kvalitet i konsentrater, prosessert med ulike metoder. Vi ønsket i tillegg å studere nivå og innflytelse av immunmodulerende substanser i TRC-K og måle utbytte, overlevelse og funksjon av transfunderte TRC. Det overordnede målet var optimalisering av TRC-kvaliteten i transfusjonsproduktene.
Studie I (11). Transfusjon av neonatale pasienter krever spesielle hensyn da de har lite blodvolum, redusert metabolsk kapasitet, høy hematokrit og et ikke fullt utviklet immunsystem (7). Det optimale TRC-produktet til neonatale er hyperkonsentrerte TRC i lite volum for å unngå sirkulatorisk overbelastning. I studien testet vi hyperkonsentrater (HC) med konsentrasjon på 2000 × 109/L i to ulike oppbevaringsløsninger (PAS) og sammenliknet dem med standard konsentrater (STDC) med konsentrasjon på 1400 × 109/L. Formålet var å evaluere TRC-kvaliteten for eventuelt å kunne utvide lagringsperioden utover daværende 24-timersgrense. Både cellekonsentrasjonen og innholdet i PAS-løsningene er viktige faktorer som påvirker TRC-kvaliteten.
TRC ble tappet fra hver donor to ganger (n=14) og produsert på fire måter: STDC og HC i de to PAS-løsningene T-Sol og PAS-27a. Deskriptive og metabolske parametre i tillegg til aktiveringsmarkører ble analysert på dag 1, 2, 3 og 4.
HC i T-Sol viste synkende kvalitet fra dag 2. Resultatene indikerer sterkt at løsningen PAS-27a, som i motsetning til T-Sol inneholder glukose, fosfat, bikarbonat, magnesium og kalium, synes å være et bedre medium for TRC-oppbevaring, både ved normal og høy konsentrasjon. Dette skyldes trolig den ekstra tilsetningen i PAS-27a, spesielt er elektrolyttene Mg++ og K+ vist å ha signifikant positiv effekt på TRC-metabolismen (12) og membranfunksjonen og nedsetter i tillegg aggregering og aktivering og forebygger akkumulering av TRC-deriverte cytokiner som CCL5 og TGF- β1.
Ut fra disse resultatene foreslår vi at lagringstiden for HC i PAS-27a kan utvides, trolig til tre dager. Et HC fra én donor kan da deles i flere satellittposer og flere transfusjoner fra samme giver kan gis til samme pasient. Dermed minimeres antall donoreksponeringer, som anbefalt av Europarådet (7). Løsningen PAS-27a, som vi testet, er ikke lenger tilgjengelig, men flere nye liknende løsninger er utviklet.
Studie 2 (13). Vi sammenliknet BC TRC-K produsert med automatisert metode på Orbisac-System, med manuelt produserte konsentrater, begge i PAS-løsningen T-Sol. Vår blodbank har tidligere vist at visse aferesemaskiner kan indusere TRC-aktivering, trolig på grunn av mekanisk stress mellom TRC og kunstige overflater som ikke er hundre prosent biokompatible (14). Vi testet TRC-kvaliteten, spesielt med hensyn til aktiveringsgrad og utskillelse av cytokiner.
Likt antall BC-konsentrater ble prosessert med de to metodene (n=21) og oppbevart i syv dager. Prøver ble analysert på dag 1, 4 og 7. De automatisk produserte konsentratene (A-PC) hadde større volum, bedre utbytte (× 1011) og bedre utbytte % enn de manuelt produserte (M-PC). Etter filtrering inneholdt A-PC-ene flere leukocytter, men færre erytrocytter enn M-PC-ene. Automatisert produksjon av BC-TRC-K med Orbisac-Systemet førte til litt høyere TRC-aktivering og høyere nivå av cytokinet CCL5, sammenliknet med manuell produksjon. Ingen forskjell ble funnet i TGF-β-nivå. Forskjellene kan trolig forklares med at TRC eksponeres mer for mekanisk stress ved automatisering.
Den kliniske betydningen av å gi TRC-K med innhold av en vis mengde cytokiner er ikke fullt klarlagt (15), men det er kjent at både CCL5 og TGF-β1 kan påvirke immunsystemet (16-18). TRC-K med høyt innhold av CCL5 har vært involvert i alvorlige allergiske transfusjonsreaksjoner (19). På tross av litt økt aktivering og høyere innhold av CCL5 i de automatisk produserte konsentratene i T-Sol, evaluerte vi metoden som nærmest ekvivalent til den manuelle metoden.
Flere studier hvor nyere PAS-løsninger er testet med Orbisac-metoden (20), og resultater fra testing av TACSI-systemet (21), virker lovende. Automatisering kan bli et hjelpemiddel for å møte det stigende behovet for TRC-produkter.
Studie 3 (22). Uavhengig av produksjonsmetode vil kvaliteten på TRC-K bli forringet under lagring. Selv om aldringsprosessen nedsettes ved 22 ± 2˚C, sammenliknet med 37˚C (23), vil «The platelet storage lesion» (PSL) føre til at TRC tømmer granula og dette fører til at immunmodulerende substanser (IMS) som cytokiner, vekstfaktorer og lipider akkumuleres i konsentratet (24-25). IMS har vært involvert i febrile, nonhemolytiske transfusjonsreaksjoner og TRALI.
Vindusperioden for infeksjonsrisiko, trusselen fra nye kommende patogener og transfusjonsrelatert sepsis, har ført til utvikling av fotokjemisk patogen-reduksjonsbehandling (PR) for TRC. Ved behandlingen inkorporeres fotokjemikalier i DNA og RNA i eventuelle patogener og leukocytter som måtte være i TRC-K, dette hindrer videre proliferering. PR-teknologien har dog vist seg å akselerere PSL (26-27).
I et paret blindforsøk undersøkte vi om PR-behandlingen INTERCEPT ville ha betydning for akkumulering av IMS. PR-behandlede og ubehandlede aferesekonsentrater fra samme donor ble testet (n=12). I tillegg til IMS’ene sCD154 og VEGF, ble deskriptive og metabolske parametre analysert på dag 1, 4 og 6. For å etterlikne situasjonen etter en transfusjon, inkuberte vi fullblod med supernatanter fra aferesekonsentrat og målte den totale effekten av IMS ved målinger av lipopolysaccharide-(LPS)-indusert sekresjon av både et proinflammatorisk (TNF-α) og et antiinflammatorisk (IL-10) cytokin. I tillegg ble prøver sendt til Denver, Colorado for analyse av priming kapasitet av nøytrofile celler (28). Dette kan ha betydning for utvikling av TRALI hos resipienten, en meget alvorlig transfusjonskomplikasjon.
INTERCEPT PR-behandling av TRC påvirker metabolismen negativt. Supernatantene fra begge gruppene av konsentrater influerte på LPS-indusert sekresjon av cytokiner. Dette indikerer at IMS akkumuleres under lagring. INTERCEPT-behandlede TRC førte til lavere LPS-indusert sekresjon av TNF-α i friskt heparinblod, sammenliknet med ubehandlede TRC, mens det ikke var forskjell i utskillelsen av IL-10. IMS-ene VEGF og sCD154 ble funnet i gradvis stigende, høye konsentrasjoner, likt i begge grupper. Supernatantene fra de to gruppene hadde samme stigende kapasitet for priming av nøytrofile utover i lagringsperioden, de antas derfor å representere lik risiko for utvikling av TRALI hos resipienten.
Studie IV (29). Vi evaluerte utfallet av TRC-transfusjoner i en klinisk setting. Målet var å spore transfunderte TRC i pasienten og studere utbytte, overlevelse og funksjon ved hjelp av vår nyutviklede flowcytometribaserte metode for HLA klasse I typing av TRC. I tillegg ønsket vi å måle om TRC «engraftment» (begynnende funksjon av transplanterte celler) etter allogen stamcelletransplantasjon kunne detekteres tidligere med denne nye metoden, sammenliknet med konvensjonelle metoder.
Metoder som tidligere har vært anvendt til å spore transfunderte TRC krever manipulasjon før transfusjon. Autolog transfusjon av TRC merket med de radioaktive isotoper 51Cr og/eller 111In til friske frivillige, har vært brukt i mange år (30). Merkingen kan aktivere TRC og redusere kvaliteten. Lekkasje av isotopene til andre celler er en utfordring (31). Alternative metoder uten bruk av radioaktive isotoper, er attraktive både av etiske og økonomiske hensyn, og av miljøhensyn (32).
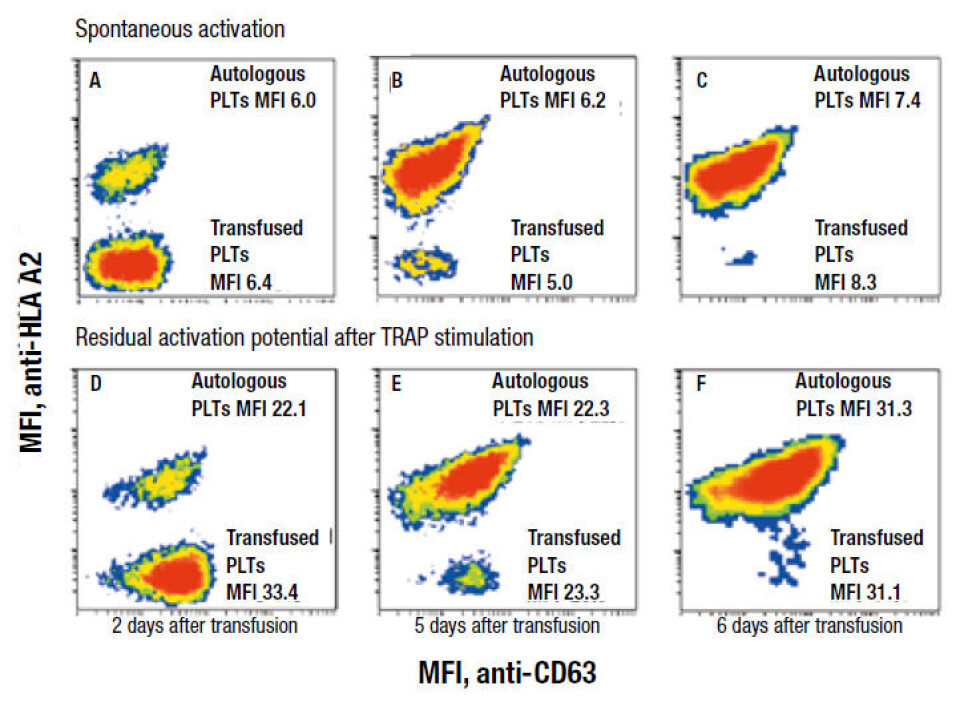
Åtte pasienter som gjennomgikk allogen stamcelletransplantasjon ble transfundert med aferese TRC med HLA klasse I type som var fremmed for pasientene (non-self), i den aplastiske fasen etter transplantasjon. Prosenten av TRC med samme HLA klasse I type som donor, i kombinasjon med TRC-konsentrasjonen, ble brukt for å måle mengden av transfunderte TRC som var til stede i pasientens sirkulasjon. Prøver ble tatt før transfusjon, én og seks timer etter hver transfusjon og deretter daglig i en uke. Flere TRC-K ble ofte gitt innen få dager, disse ble gitt med HLA klasse I type som var fremmed for pasienten og forskjellig fra den forrige transfusjonen, slik at flere populasjoner av TRC kunne følges samtidig. Hematologisk status og uttrykk av HLA klasse I på TRC ble målt i tillegg til TRC-aktivering før og etter thrombin receptor agonist peptide (TRAP)-stimulering (figur 2).
TRC-utbyttet var 43, 41 og 31 prosent for friske (5-72 timer gamle) TRC etter henholdsvis en, seks og 15-28 timer. Tilsvarende for lagrede TRC (73-148 timer gamle) var 30, 27 og 17 prosent. Overlevelse av friske versus lagrede TRC var henholdsvis 160 og 105 timer. Spontan aktivering og rest aktiveringspotensial var tilnærmet likt for friske og lagrede TRC.
TRC engraftment ble påvist med flowcytometri mellom dag syv og ni, hvilket var signifikant tidligere enn første tegn på nøytrofil engraftment (dag 11-19), som er rutinemetoden for indikasjon av engraftment på vårt sykehus i dag.
Metoden kan brukes i klinisk sammenheng til samtidige studier av utbytte, overlevelse og funksjon av transfunderte TRC. Metoden er et attraktivt alternativ til måling med radioaktive isotoper.
Ingen tidligere metoder for måling av TRC-utbytte og overlevelse har kunnet gi svar på om TRC fungerer etter transfusjon, kun at de fins i sirkulasjonen (31). Vi utvidet vår metode til også å inkludere måling av TRC-funksjon ved å analysere spontan og TRAP-indusert aktivering (respons). Avhengig av gating-strategien på flowcytometeret var det mulig å studere funksjonen til ulike populasjoner av TRC samtidig: pasientens egne TRC i perioden med nedsatt thrombopoiese, de transfunderte TRC og de nye TRC produsert av de transplanterte cellene.
Konklusjoner
- Bedre kvalitet og utvidet lagringsperiode av HC er mulig ved bruk av PAS som inneholder glukose, fosfat, Mg++, K+ og bikarbonat. Flere transfusjoner fra en enkelt donor til en og samme neonatale pasient blir mulig.
- Automatisert produksjon av BC TRC-K med Orbisac-metoden kan føre til økt TRC-aktivering, trolig på grunn av økt mekanisk stress. Forskjellen er sannsynligvis av mindre klinisk betydning.
- INTERCEPT PR-behandlingen av TRC påvirket metabolismen negativt ved å akselerere PSL. Behandlingen synes ikke å øke risikoen for TRALI, men supernatanter fra PR-behandlede TRC førte til lavere LPS-indusert utskillelse av TNF-α i frisk blod enn supernatanter fra ubehandlede TRC. Forklaringen på dette funnet er ukjent, men da TNF-α er et cytokin med en viktig rolle i immunresponsen bør dette utredes videre.
- Non-radioaktiv testing av utbytte, overlevelse og funksjon av transfunderte TRC kan utføres med HLA klasse I-typing av TRC med multi-color flowcytometri. I tillegg kan metoden brukes til raskere deteksjon av TRC engraftment etter stamcelletransplantasjon enn dagens konvensjonelle metoder.