FAG i praksis
HISTORISK ARTIKKEL: Lipoproteinenes fysiologi og patofysiologi
Bioingeniøren er 50 år i år, og vi markerer det ved å hente frem noen av bladets første fagartikler fra arkivskuffene. Denne artikkelen er fra Fysiokjemikeren, som bladet da het, nr. 5, 1966.
Økt innhold av fett i serum går under en rekke betegnelser. Hyperlipidemi betyr økt innhold av totallipider og hyperlipemi betyr økt mengde av nøytraIfett eller triglycerider i serum. Videre har vi begreper som hypercholesterolemi og hyperfosfolipemi. Det er i dag en tendens til å gå fra disse betegnelser. Årsaken til dette er en større forståelse av blodets lipoproteiner. Som kjent er ikke fett løselig i vann. Fett som eksisterer i serum må være bundet til proteiner for å være løselige. Ved økt fettinnhold i blodet er det økte mengder av lipoproteiner i blodet. Det kommer an på hvilke lipoproteinfraksjoner som er økt om vi skal få en hyperlipemi, en hypercholesterolemi eller en hyperfosfolipemi. Men før vi kommer nærmere inn på dette skal vi se hvilke metoder vi har til rådighet for å bestemme og adskille de forskjellige lipoproteinfraksjoner.
I 1950·årene utarbeidet Gofman og medarbeidere en metode til å adskille lipoproteinene etter deres egenvekt. Til dette brukte de ultrasentrifugen. Rent fett har egenvekten 0,9, rent protein 1,35, og lipoproteinenes egenvekt ligger mellom disse grenseverdier. Gofman delte inn lipoproteinene i to hovedgrupper: «high density» lipoproteiner, som har egenvekt høyere enn 1,063, og <low density» lipoproteiner som har egenvekt lavere enn 1,063. De sistnevnte kan igjen deles inn i flere undergrupper etter sin egenvekt. Lipoproteinene sentrifugeres gjerne i medier med egenvekt som er høyere enn lipoproteinenes. Derved vil disse flyte opp mot overflaten. Jo lettere de er, dess fortere vil de nå overflaten i sentrifugetuben. Den hastighet som de flyter opp med, eller floterer med, kan tallmessig uttrykkes i såkalte flotasjonsenheter eller Sf-verdier. Jo høyere Sf-verdi et lipoprotein har, dess lettere er det. De lette lipoproteiner deles gjerne inn i tre undergrupper. En gruppe er de vanlige low density lipoproteiner, som har Sf-verdier meIlom 0 og 20. Den andre undergruppen går under navnet very low density lipoproteiner, og har Sf-verdier mellom 20 og 400. Endelig har vi chylomicron, som har Sf-verdier over 400. Det kan med ultrasentrifugen være meget vanskelig å skille mellom de letteste av very low density lipoproteiner og de tyngste chylomicron. Gofmans ultrasentrifugeringsmetode har vært meget betydningsfull for forståelsen av lipoproteinenes fysiologi, men metoden krever en omfangsrik og kostbar instrumentpark, og kan vanskelig brukes i rutinen. En har derfor lett etter enklere metoder.
Metoden krever en omfangsrik og kostbar instrumentpark, og kan vanskelig brukes i rutinen.
I løpet av de siste årene er det utviklet en elektroforesemetodikk som har vist seg meget anvendelig for adsikillelsen av de ulike lipoproteiner. Man kjører ganske enkelt elektroforese på vanlig papir i en barbitursyrebuffer som er tilsatt 1 % albumin. Derved får man ganske god separering av følgende komponenter: Chylomicron blir liggende på startstreken. I nærheten av området der de vanlige βglobulinene finnes, får man to bånd, det er de såkalte β-Iipoproteiner og pre-β-lipoproteiner. Lengere fremme, omtrent på albuminets plass finner man α-lipoproteinene. I normalserum vil man ikke finne pre-β-stripen, da lipoproteinene som danner denne stripen finnes i små konsentrasjoner normalt. De chylomicron man bestemmer ved elektroforese svarer omtrent til det Gofman kalte chylomicron. β-lipoproteinene svarer til low-density lipoproteiner, og pre-β-lipoproteiner svarer til very low-density lipoproteiner. α-lipoproteiner er det samme som high density lipoproteiner.
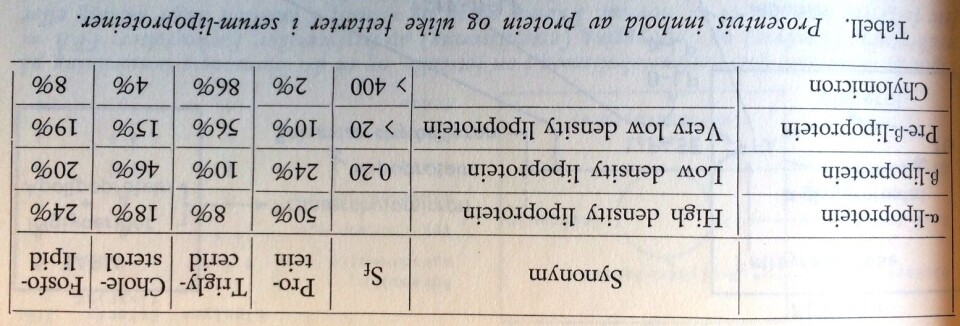
Sammensetningen av de forskjellige lipoproteiner divergerer meget. Dette sees av tabellen, som også repeterer inndelingen av dem, og angir deres Sf-verdier. α -lipoproteinene inneholder ca. 50 % protein, β-lipoproteinene ca. 23 % protein og pre-β-lipoproteinene ca. 10 % protein. Det er mest av triglycerider i pre-β-lipoproteinene og i chylomicron, mens cholesterolet hovedsaklig er til stede i β-lipoproteinene. FosfoIipidene er ikke fullt så skjevt fordelt. I klinikken er det for tiden vanlig å si at pasienter har f. eks. en hyperlipemi, en hypercholesterolemi eller en hyperfosfolipemi. Dette er ikke korrekte angivelser, fordi det egentlig er hyperlipoproteiner som foreligger ved tilstander hvor disse fettarter finnes i økt konsentrasjon i serum. En hyperlipemi vil vi ha når det er økt innhold av pre-β-lipoproteiner eller av chylomicron. En hypercholesterolemi viI vi ha når β-lipoproteinene finnes i forhøyet konsentrasjon, og økt innhold av fosfolipider i plasma vil vi ha hvis α- eller β-lipoproteinene finnes i økte konsentrasjoner.
Vi har nå definert såvidt mange begreper vedrørende lipoproteinene at vi kan forsøke å få en oversikt over deres fysiologi. Proteindelen av lipoproteinene kalles apo-lipoproteiner. α-lipoproteinets proteindel kalles protein A. Dette protein er forskjellig fra β-lipoproteinenes apo-lipoprotein, som kalles protein B. Pre-β-lipoproteinets proteindel er en blanding av protein A og B. Tilnærmet kan pre-β-lipoproteinet oppfattes som et komplekst makromolekyl bygget opp av α- og β-lipoproteiner koblet sammen med triglycerider.
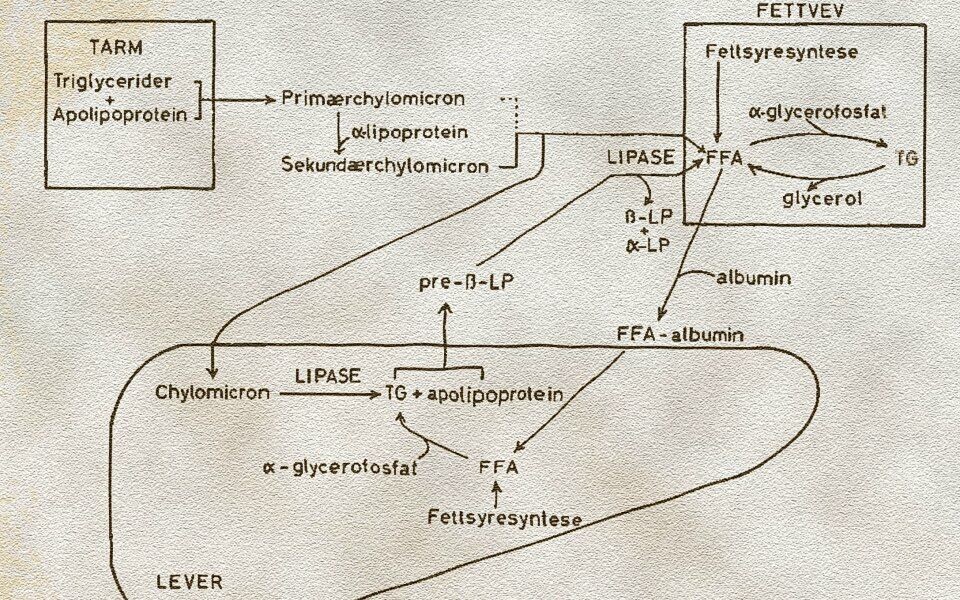
Figur 1 viser lipoproteinenes transportfunksjon. I tarmveggens epitelceller gjendannes triglycerider fra fettsyrer og glycerol som er resorbert fra tarmkanalen. Triglyceridene kobles til et apo-lipoprotein, antagelig protein B, og derved dannes de primære chylomicronpartikler, som etter at de er vandret ut i lymfebanene etterhvert kommer over i blodet. Her omdannes de primære chylomicron til såkalte sekundære chylomicron ved at protein A eller α-lipoprotein kobles til dem. Omtrent 40 % av chylomicron tas opp av lever, resten fordeles til fettvev og muskulatur. I leveren tas antagelig chylomicron opp som hele partikler, men i andre vev blir triglyceridene spaltet utenfor cellene, slik at det er bare de frie fettsyrene som trenger inn i cellene. Avhengig av kroppens metabolske situasjon vil en større eller mindre del av fettet forbrenne. Resten lagres til senere bruk. Fett i organismen lagres som triglycerider, men transporteres som frie fettsyrer koblet til albumin, eller som triglycerider koblet til lipoproteiner. Den førstnevnte av disse to transportformer er langt den viktigste.
Man vet relativt lite sikkert om Iipoproteinenes dannelse og degradering.
Blodets innhold av frie fettsyrer kommer i sin helhet fra fettvevet. De frie fettsyrene blir hydrolysert fra fettvevets lager av triglycerider ved hjelp av en lipase. Dette enzymet er påvirket av en rekke hormoner. De frie fettsyrene som transporteres bundet til albumin fordeler seg til forskjellige organer i kroppen. Relativt store mengder av fettsyrene når leveren, hvor de igjen forestres med α-glycerofosfat til triglycerider. Triglyceridene kobles til apo-lipoproteiner og forlater leveren som pre-β-lipoproteiner, som igjen transporterer triglyceridene til forskjellige organ i kroppen. Perifert vil pre-β-Iipoproteinet bli spaltet i sine komponenter, α-lipoprotein, β-lipoprotein og triglycerider. De sistnevnte hydrolyseres av lipaser til frie fettsyrer og glycerol, og de frie fettsyrene kan trenge inn i de perifere vevs celler.
Man vet relativt lite sikkert om Iipoproteinenes dannelse og degradering. Men stort sett kan vi si at leveren er hovedstedet for syntesen av proteindelen til lipoproteinene. Det er viktig å være oppmerksom på at leveren har en meget begrenset kapasitet til å lagre triglycerider; den vil derfor prøve å kvitte seg med tilført og nydannet fett så fort som mulig. En økt tilførsel av fett til leveren eller en økt nydannelse av fett i leveren vil derfor være en sterk stimulus til dannelse av pre-β-lipoproteiner.
Økt innhold av fettarter i serum kan opptre sekundært i tilslutning til en rekke sykelige tilstander. Videre har vi en del primære hyperlipoproteinemier. For forståelsen av alle disse sykelige tilstander er det nødvendig med et visst kjennskap til fettstoffskiftet i fettvevet.
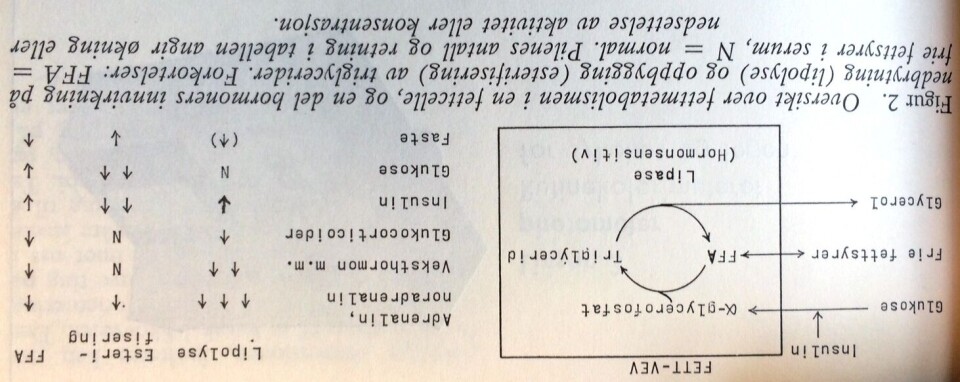
I figur 2 er en fettcelle skjematisk tegnet. I en slik celle foregår det en stadig oppbygging og nedbrytning av triglycerider. Oppbyggingen av triglycerider fra frie fettsyrer stimuleres av glukose, som ved sin nedbrytning gir opphav til α-glycerofosfat. Insulin vil fremme denne prosessen ved at glukosetransporten inn i fettcellene stimuleres. Nedbrytningen av triglycerider til frie fettsyrer og glycerol er som tidligere anført katalysert av en hormonsensitiv lipase. Adrenalin og noradrenalin stimulerer lipolysen (hydrolysen og triglyceridene) og det samme gjør en rekke andre hormoner, som binyrebarkhormoner, veksthormon og en del andre hypofysære produkter. Insulin virker motsatt, slik at det vesentlig under insulinpåvirkning vil finne sted en oppbygning av triglycerider i fettcellen. Ved glukoseoverskudd og derved insulinfrigjøring fra pancreas vil derfor de frie fettsyrene i serum synke. Det motsatte vil finne sted ved faste eller ved insulinmangel. Dette kan forklare den økte mengde av fettarter en kan finne hos pasienter med diabetes. Videre kan fettmetabolismen i fettvevet forklare de sekundære «hyperlipemiske» tilstander en ser ved langvarig stress (økt adrenalin og noradrenalin), ved Cushings' sykdom (økt produksjon av binyrebarkhormoner), og i svangerskapet (økt produksjon av veksthormon).
HyperIipoproteinemier kan en også finne sekundært til en rekke andre sykelige tilstander, slik som kronisk alkoholisme, nefrose, hypothyreoidisme og staseikterus. Det vil imidlertid bli for spesielt her å anføre de mulige patofysiologiske mekanismer som ligger til grunn for disse sekundære hyperlipoproteinemier.
Hyperlipoproteinemiene deles inn i fem grupper eller fenotyper.
En har i lang tid prøvd å få klassifisert de familiære, primære sykdommer karakterisert ved økt innhold av fettarter i serum. Som nevnt innledningsvis har vanskene delvis vært av teknisk natur, idet en inntil for nylig bare kunne gjøre bruk av ultrasentrifugering for sikkert å kunne adskille de forskjellige lipoproteiner. Fredrichson, som har vært med på å utarbeide den tidligere nevnte elektroforesemetodikk for adskillelse av lipoproteinene, har nylig satt opp et skjema for inndeling av de familiære hyperlipoproteinemiene.
Hyperlipoproteinemiene deles inn i fem grupper eller fenotyper. Den første fenotype er den familiære hyperchylomicroemien. Disse pasientene har sterkt lipemisk serum, mens cholesterolverdiene er relativt normale. Årsaken til denne sykdommen er antagelig at pasientene mangler et enzym (lipoprotein-lipase) som spalter chylomicron. Denne typen hyperlipoproteinemi er fettindusert; pasientenes serum normaliseres om de holder en fettfattig kost. Den andre fenotypen kalles den familiære hyper-β-lipoproteinemien, kanskje bedre kjent under navnet essensiell hypercholesterolemi, eller Müller-Harbitz' sykdom. Hos disse pasienter er serum klart. Serumcholesterol er sterkt forhøyet. Pasientene har xanthomknuter og har en sterkt økt tendens til å få hjerteinfarkt.
En tredje fenotype er den såkalte familiære hyperpre-β-lipoproteinemi. Dette er en relativt hyppig lidelse. Pasientenes serum er turbid, de har økte konsentrasjoner av trigIycerider i serum, mens cholesterol bare er moderat forøket. Denne sykdommen er kullhydratindusert. Det vil si at pasientene har en økt tendens til å omdanne kullhydrater til fett. Disse pasientene skal derfor spise lite av sukkerarter, og heller mer fett. Denne sykdommen har også nær relasjon til hjerteinfarkt. Det har vist seg at en stor prosent av yngre mennesker som får hjerteinfarkt har forhøyede verdier av pre-β-lipoproteiner i serum. De to siste fenotyper er kombinasjoner av de tre førstnevnte fenotyper. Således kan en skille ut en hyperpre-β-lipoproteinemi, og en annen gruppe som har hyperchylomicronemi og hyperpre-β-lipoproteinemi.
Inndelingen til Fredrichson er ny, og det er for tidlig å si noe sikkert om hva den kommer til å gi. Men den er i alle fall det hittil beste forsøk på å systematisere de familiære sykdommer med økt innhold av fettarter i serum. Og inndelingen av sykdomsgruppene ved hjelp av papirelektroforese i albuminholdige buffer er en relativt enkel metode. Vi har ved Rikshospitalets Sentrallaboratorium satt opp denne metode, og vi har allerede samlet en del interessante data.
























