FAG i praksis
En kort innføring i immunologi
Immunologi er læren om kroppens forsvarssystem – immunsystemet. Immunsystemet er utviklet for å beskytte kroppen mot fysisk, kjemisk og biologisk angrep. Antigenpresenterende celler spiller en sentral rolle ved at de presenterer fremmed materiale på plasmamembranen og er bindeleddet mellom det medfødte og det ervervede immunsystemet.
Av LIV THOMMESEN, professor, Institutt for bioingeniørutdanning, NTNU og KIRSTI BERG, vitenskapelig redaktør, Tidsskriftet Bioingeniøren
En kort innføring i immunologi.pdf(553 KB)
Immunsystemet har som oppgave å beskytte kroppen mot infeksjoner og annet materiale som oppfattes som fremmed for kroppen - «ikke selv». Gjennom hele livet blir vi kontinuerlig utsatt for fremmede stoffer, og immunsystemet vårt justeres tilsvarende til best mulig å gjenkjenne fremmed materiale. Immunsystemet deles inn i det medfødte (ikke-spesifikke) og det ervervede (spesifikke, adaptive) immunsystemet (figur 1), og samspillet mellom disse er avgjørende for utvikling av en effektiv immunrespons.
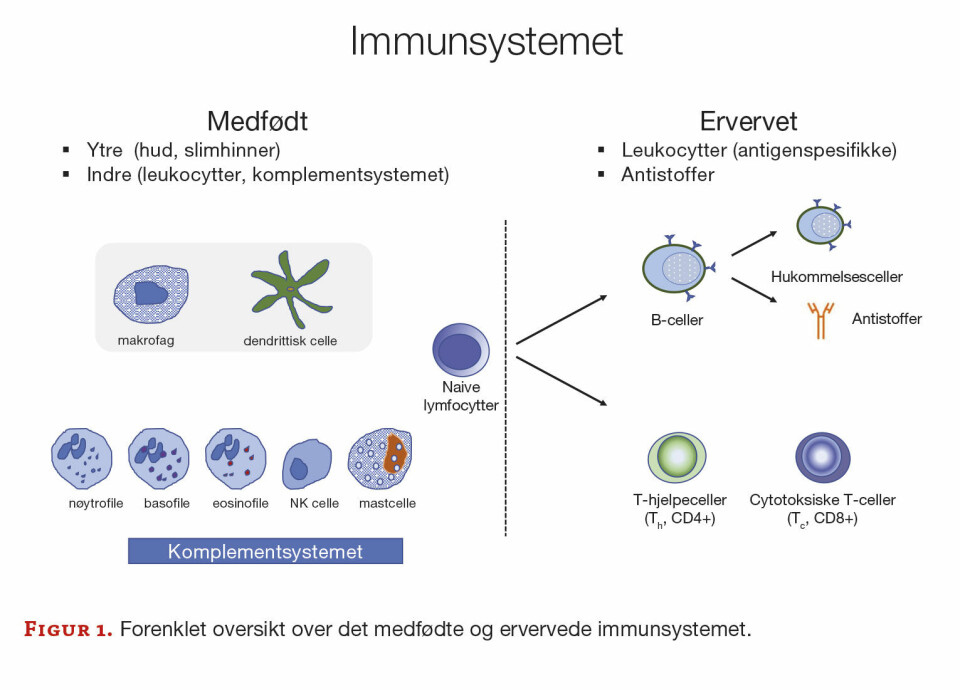
Det medfødte immunsystemet
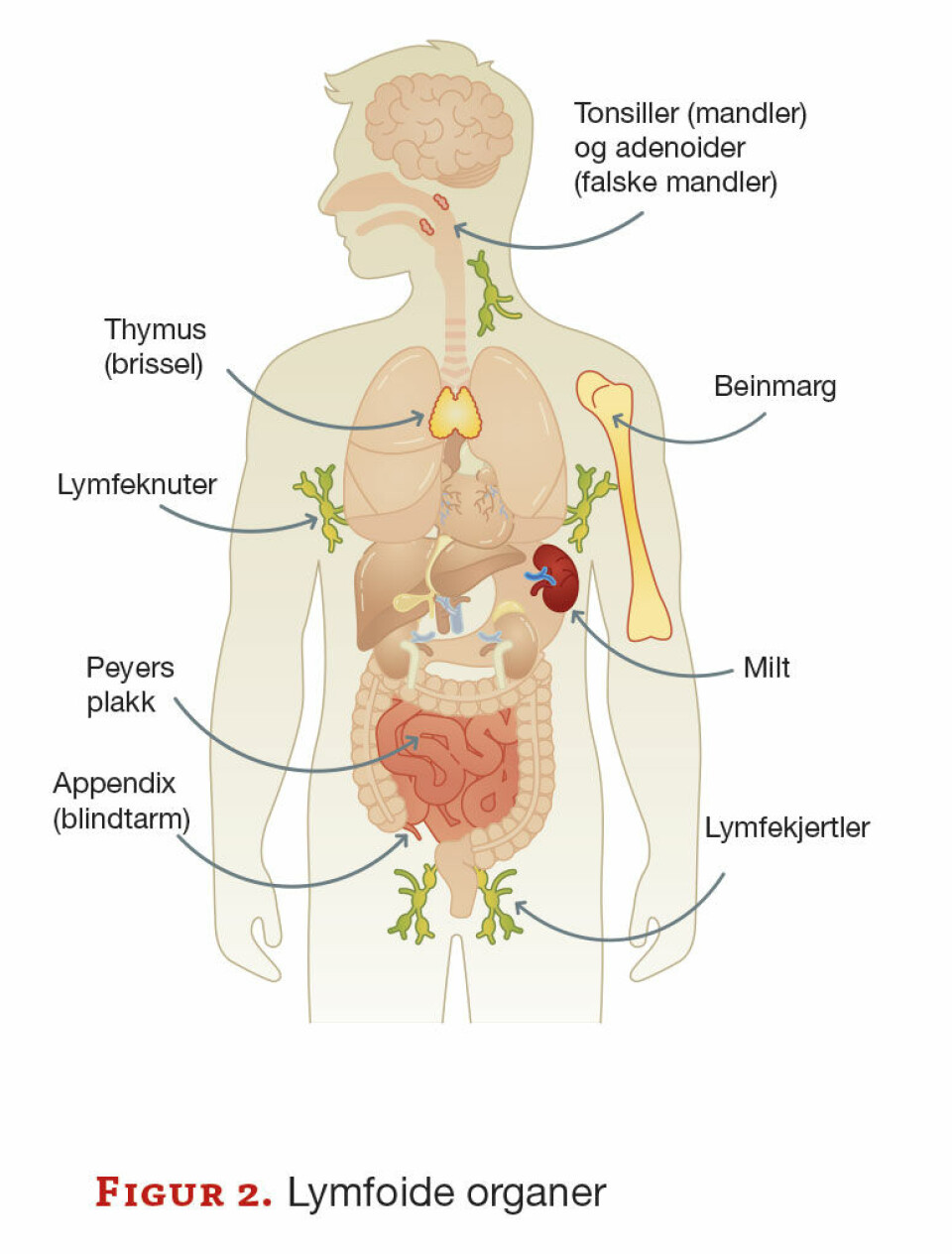
Det medfødte immunsystemet deles inn i et ytre og et indre system. Det ytre omfatter alle fysiske barrierer som hud og slimhinner, mens det indre omfatter immunceller og løselige proteiner, samt de lymfoide organene hvor immunceller produseres og modnes (figur 2).
Felles for immunceller er evnen til å gjenkjenne og binde fremmede strukturer (f.eks. bakterier og virus) som i påfølgende prosesser fører til degradering.
Komplementsystemet er en betegnelse på en samling av løselige proteiner i plasma. Disse utgjør ett av kroppens kaskadesystemer, det vil si proteiner som virker sammen på en bestemt måte for å utøve ulike biologiske funksjoner. Mange bakterier og virus har overflatemarkører som aktiverer komplementsystemet, og som fører til en kaskade av proteinaktiveringer. Dette bidrar til å effektivisere immuncellers fagocytose eller fører til lysering (apoptose). Signalmolekyler, som blant annet cytokiner, prostaglandiner og histaminer, spiller en sentral rolle ved å påvirke modning av nye immunceller (f eks. makrofager og nøytrofile granulocytter).
Det ervervede immunsystemet
Med det ervervede immunsystemet (adaptive) forstår vi utvikling av immunkompetente T- og B-lymfocytter (såkalte effektorceller) fra naive lymfocytter. Effektorcellene står for selve bekjempelsen av de sykdomsfremkallende mikrobene.
Antigenpresenterende celler
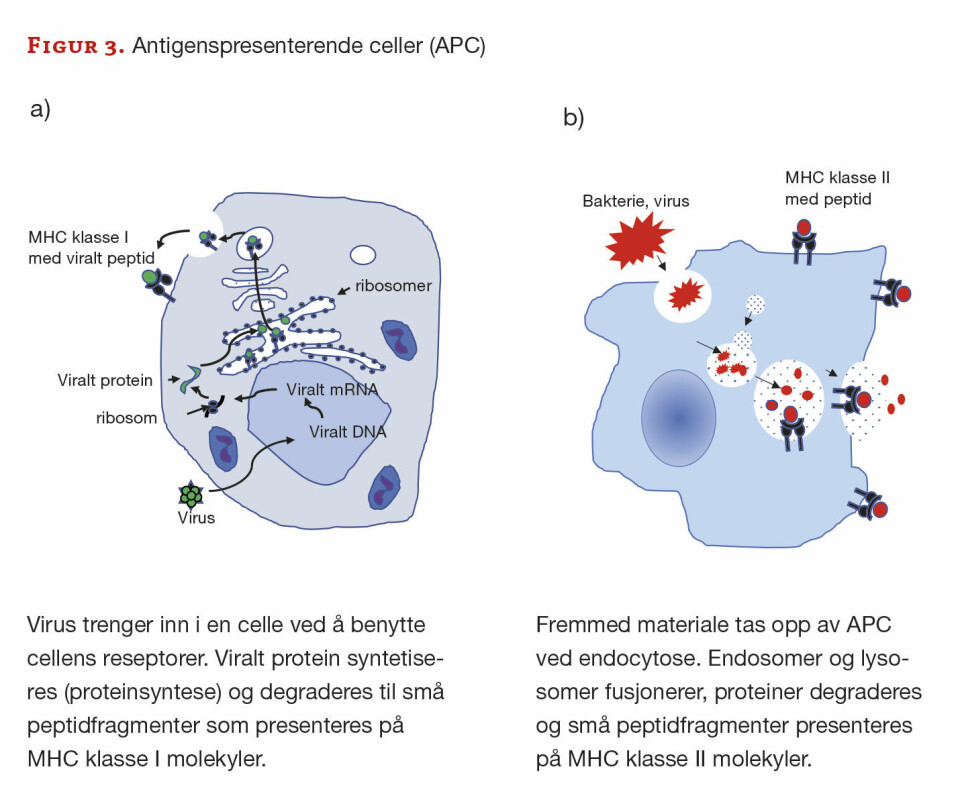
Antigenpresenterende celler (APC) er celler som bearbeider og «presenterer» et antigen for T-lymfocytter (T-celler). APC kan uttrykke to ulike typer reseptorer – MHC I eller MHC II (major histocompatibility complex, tidligere HLA I og HLA II). Alle kjerneholdige celler uttrykker MHC I, hvor de naturlig presenterer kroppsegne peptider. Men ved eksponering av fremmed materiale presenteres fremmed peptid. Om peptidene presenteres på MHC I eller MHC II avhenger av hvordan cellen er blitt eksponert for det fremmede materialet. MHC I presenterer peptidfragmenter fra proteiner syntetisert endogent i vertscellen eksempelvis etter en virusinfeksjon (viruspeptider), mens MHC II presenterer peptidfragmenter fra materialer tatt opp ved endocytose (figur 3). Peptidfragmentene festet til henholdsvis MHC I eller MHC II blir presentert for T-cellene og fører til enten en humoral eller cellulær respons.
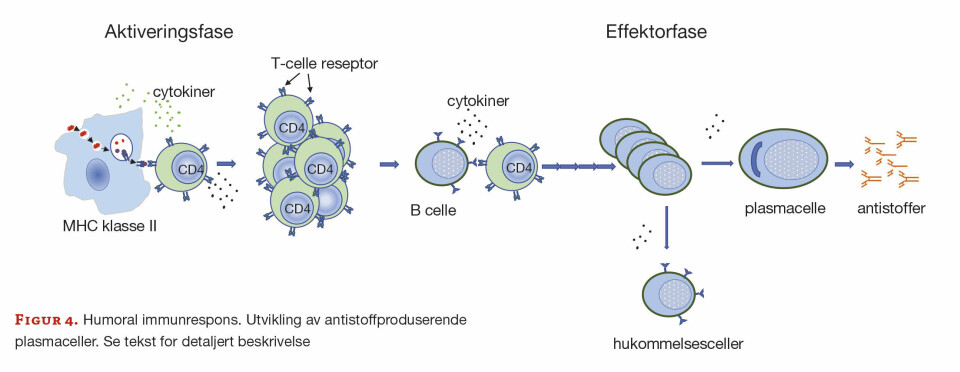
Humoral respons
Ved en humoral respons blir fremmed materiale (antigen) til slutt degradert ved hjelp av spesifikke antistoffer. Denne responsen foregår i to faser – en aktiveringsfase (i) og en effektorfase (ii) (figur 4): i) kontakt mellom APC og CD4 positive T-celler (CD4+) fører til aktivering og en påfølgende klonal proliferasjon av T-cellene. En annen nomenklatur for CD4+ T-celler er T-hjelpeceller (Th); ii) aktiverte T-hjelpeceller gjenkjenner B-lymfocytter (B-celler) som uttrykker MHC II/peptidfragment og fører til klonal proliferasjon av B-cellene. Deretter utvikler B -celler seg til enten antistoffproduserende plasmaceller eller hukommelsesceller. Både APC og T-cellene skiller ut cytokiner (parakrint og autokrint) som styrer prosessen. Komplekset bestående av bakteriepeptider og MHC II gjenkjennes av Th. Dendrittiske celler, B-lymfocytter, makrofager og Langerhanske celler i hud har alle MHC II-molekyler på plasmamembranen.
Cellulær respons
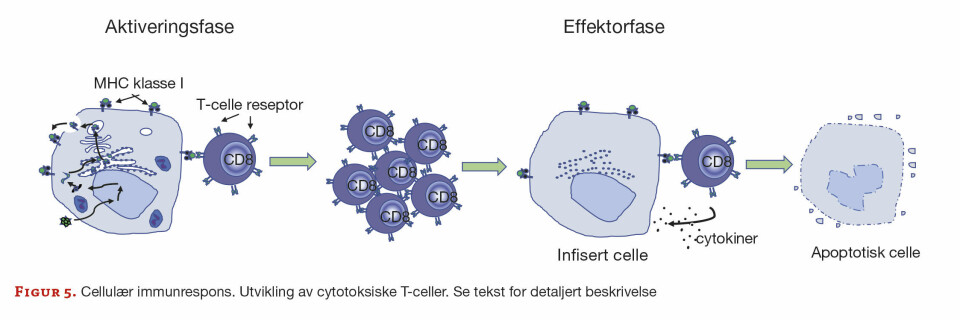
Ved en cellulær respons blir antigenet degradert ved hjelp av CD8 positive (CD8+) T-celler. Denne celletypen omtales også som cytotoksiske T-celler (Tc ). Responsen er i likhet med humoral respons delt inn i en aktiveringsfase (i) og en effektorfase (ii) (figur 5): i) kontakt mellom APC og Tc fører til klonal ekspansjon av Tc. ii) Tc binder seg til den infiserte cellen (som uttrykker MHC I/peptidfragment) og induserer celledød (apoptose). Også ved en cellulær respons skilles det ut cytokiner som regulerer hendelsesforløpet. MHC I uttrykkes på kjerneholdige celler og trombocytter. Komplekset bestående av viruspeptid og MHC I gjenkjennes av Tc.
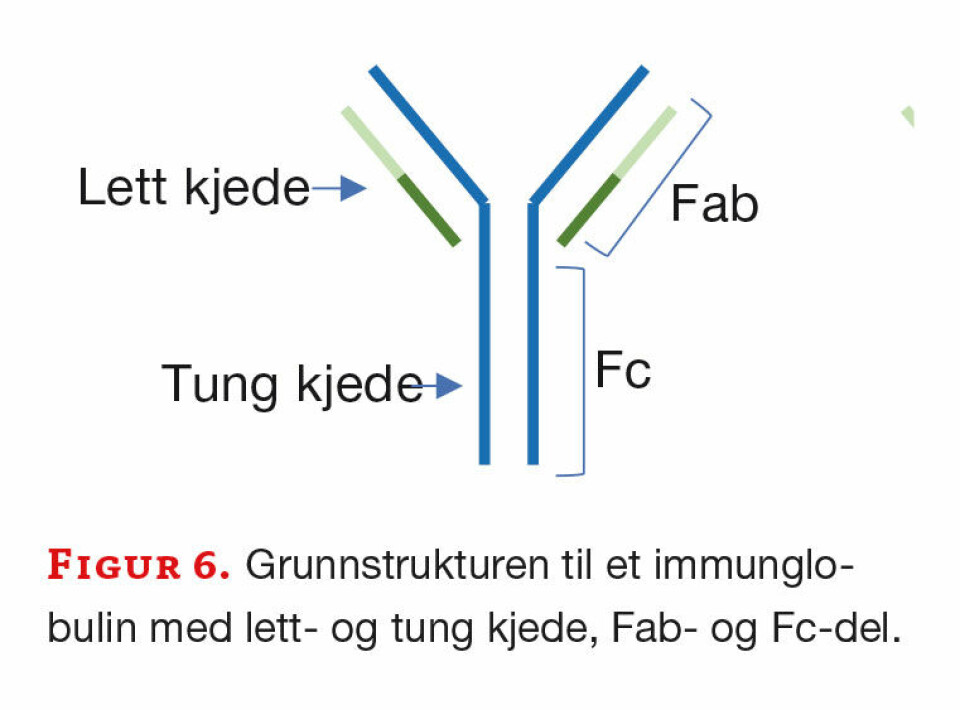
Immunglobuliner (Antistoffer)
Antistoffer eller immunglobuliner (Ig) deles inn i fem ulike klasser; IgG (monomer), IgA (dimer), IgD (monomer), IgE (monomer), og IgM (pentamer). Disse har samme grunnstruktur som består av to lette (L-light) og to tunge (H-heavy) immunglobulinkjeder og danner en klassisk Y-form med to like antigenbindende «armer» (Fab, fragment antigenbinding). Den nederste delen (Fc, fragment of crystallization) deltar blant annet i aktivering av komplementkaskaden og kan binde seg til Fc-reseptorer som finnes på immunceller knyttet til det medfødte immunsystemet (figur 6).
Utvikling av immunkompetente B-celler
B-celler produseres i beinmargen hvor de går gjennom flere stadier fra stamcelle til naiv B-celle før de slippes ut i blodbanen. Det produseres cirka 5 x 106 B-celler i døgnet. Naive B-celler uttrykker i utgangspunktet kun IgD- og IgM-reseptorer på plasmamembranen, men dette endres til produksjon av andre immunglobulinklasser (immunglobulin klasseskift) som følge av en cytokinindusert aktivering.
Den naive B-cellen utvikles til en immunkompetent celle i lymfeknutene. Dette foregår i et samspill med APC og Th, hvor somatisk hypermutasjon av B-celle-reseptoren spiller en viktig rolle. Dersom reseptoren på B-cellene binder seg til fremmed peptid vist fram av APC - og da med en viss affinitet – vil denne klonen av B-celler proliferere. Kloner som binder antigenet svakt eller som bindes til kroppens egne peptider dør ved apoptose. Det foregår med andre ord en reaksjon hvor B-cellen «lærer» å skille kroppsegne proteiner fra fremmede proteiner og kun B-celler som gjenkjenner fremmede proteiner slippes ut i sirkulasjon. B-celler som har bundet fremmed antigen interagerer med Th i lymfeknutene, og kan videreutvikles til hukommelsesceller eller antistoffproduserende celler (plasmaceller) (figur 5). Vi har til enhver tid cirka 1014 - 1016 ulike antistoffer i blodet. Antistoffsammensetningen blir kontinuerlig justert som følge av hvilke antigener vi blir eksponert for.
Utvikling av immunkompetente T-celler
T-celler produseres i beinmargen, men utvikles og modnes i thymus. Vi har et stort utvalg av T-cellereseptorer (TCR) som strukturelt likner immunglobuliner og disse kan binde ulike antigener. Fra beinmargen vandrer T-cellene til barken av thymus hvor den første utvelgelsesprosessen av T-celler foregår. Bare T-celler som viser svak spesifisitet for kroppens egne MHC-molekyler overlever og modnes videre (positiv seleksjon). Deretter vandrer T-cellene mot margen av thymus hvor de møter makrofager og dendrittiske celler (APC). T-celler som reagerer for kraftig mot kroppsegne MHC-molekyl dør ved apoptose (negativ seleksjon). T-celler som passerer disse to seleksjonstrinnene slippes ut av thymus som immunkompetente celler og vandrer videre til blod, lymfe og sekundære lymfoide organ. Feil i utvikling av B- og T-celler er en medvirkende årsak til autoimmune sykdommer.
Flere CD-molekyler spiller en viktig rolle i regulering av immunresponsen
CD (cluster of differentiation) er et nomenklatursystem som benyttes for karakterisering av plasmamembranproteiner (overflatemarkører) som finnes på leukocytter, makrofager og endotelceller. Det finnes en rekke CD-molekyler med hver sin særegne struktur og funksjon, og som derfor blir benyttet for fenotyping av immunceller. CD4- og CD8-molekylene spiller en sentral rolle i aktivering av T-lymfocytter og fungerer som ko-reseptorer for T-celleaktivering som vist i figur 4 og 5.
Men for at T-celler skal utvikle seg til fullstendige effektorceller kreves to aktiveringssignaler. Det ene formidles mellom MHC og TCR som tidligere omtalt (signal én). Det andre signalet formidles via membranproteiner hvor CD28 er blant de viktigste. CD28 bindes til CD80/86 som befinner seg i membranen til APC (signal to) (figur 7). Når T-celler binder seg til APC som uttrykker CD80/86, vil T-cellen utvikle seg til en fullstendig effektorcelle og påfølgende immunrespons. I fravær av CD80/86 kan ikke T-cellen utvikle seg, og det oppstår anergi (ingen immunrespons).
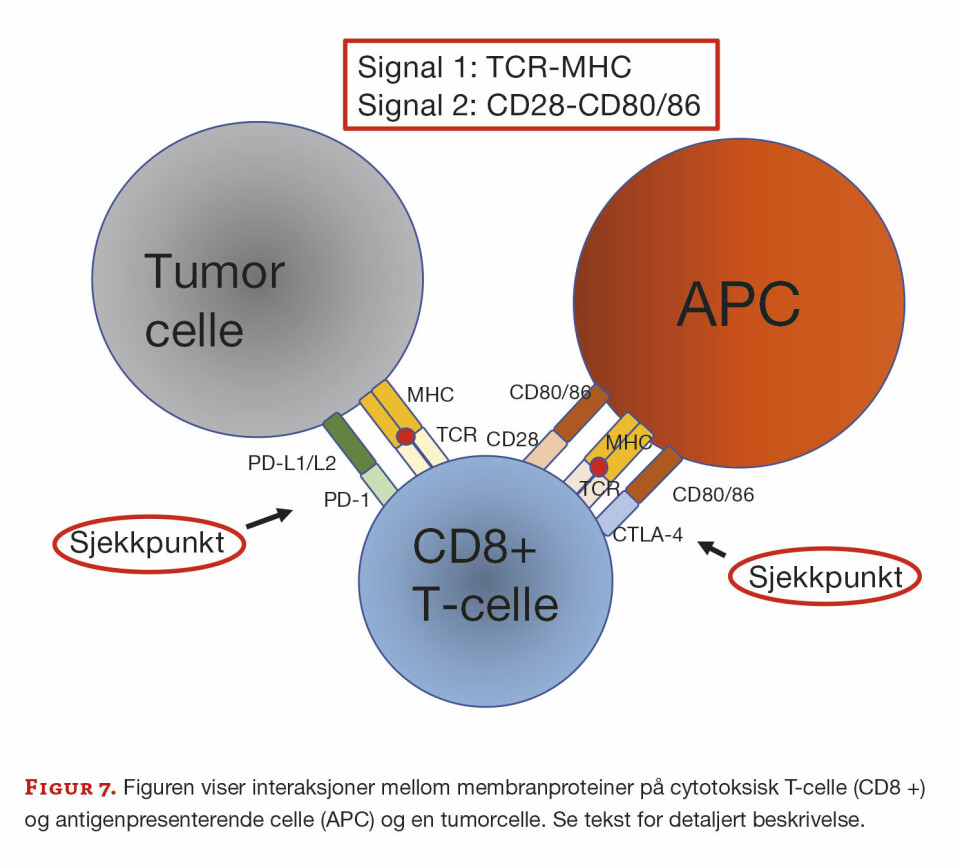
Bremsemolekyler
For at en immunrespons ikke skal «løpe løpsk», må den reguleres med systemer som kan «skru av» responsen når det ikke er behov for den lenger. Immunceller uttrykker membranproteiner som «skrur av» et aktiveringssignal etter en viss tid. Slike membranmolekyler omtales ofte som immunsjekkpunkter eller bare sjekkpunkt, og et sentralt membranmolekyl med en slik funksjon er CTLA-4 (cytotoksisk T-lymfocytt antigen 4). CTLA-4 er homologt til CD28 og blir uttrykt etter at T-cellene er fullstendig aktivert med signal én og to. CTLA-4 binder seg til CD80/86 med større affinitet enn CD28. Resultatet av denne bindingen er motsatt effekt av CD28; CTLA-4 bidrar til å bremse aktivitet i T-lymfocytter. CTLA-4 er ikke bare viktig for T- celleresponsen, men for immunresponsen generelt.
Et annet membranmolekyl med sjekkpunktfunksjon er PD-1 (programmert celledødprotein 1, CD279). PD-1 tilhører samme familie av immunglobuliner som CD28/CTLA-4, og uttrykkes på T-lymfocytter og pro-B-lymfocytter, og har en tilsvarende rolle som CTLA-4 i å bremse eller nedregulere immunresponsen. PD-1 har en viktig funksjon i å skille kroppsegne proteiner fra fremmede og hindre autoimmunitet. PD-1 binder ligandene PD-L1 og PD-L2.
Når kreftceller unngår å bli oppdaget av immunsystemet er det fordi kreftceller kan uttrykke slike «bremsemolekyler» på plasmamembranen og dermed «skru av» funksjonen til T-celler. Uttrykk av PD-L1 på tumorceller hemmer T-cellerespons gjennom binding av PD-1-reseptoren på T-celler (figur 7). PD-1 APC-inhibitorer er en klasse av medikamenter som blokkerer PD-1, og dermed aktiverer immunsystemet til å angripe tumorceller. Forståelsen av disse mekanismene er bakgrunnen for utvikling av immunterapi.
Artikkelen er basert på følgende kilder:
Lea T. Immunologi og immunologiske teknikker. Oslo: Vigmostad & Bjørke AS; 2006.
Roitt I. Essential immunology. USA: Wiley-Blackwell; 2017.
Kindt TJ, Goldsby RA, Osborne BA, Kuby J. Kuby Immunology. USA: W.H. Freeman & Co Ltd; 2007.
Khan FH. The element of Immunology. Dehli: Upper Saddle River, N.J.: Pearson Education; 2009.























