Av THERESE MARVIK DAHL og CATHRIN LYTOMT SALVADOR
Bakgrunn
Nevrotransmittersykdommer er sjeldne medfødte metabolske sykdommer som er underdiagnostisert i Norge, og det er behov for økt fokus på denne sykdomsgruppen. Tidligere ble prøver sendt fra Oslo universitetssykehus-Rikshospitalet (OUS-RH) til Tyskland for analyse. Prosessen med forsendelse og analyse ved et utenlandsk laboratorium er både tidkrevende og kostbar. I tillegg vil lang transporttid øke risikoen for at prøvematerialet forringes.
Etter ønske fra Barnenevrologisk seksjon OUS-RH har Seksjon for medfødte metabolske sykdommer (Avdeling for medisinsk biokjemi OUS-RH) etablert analyser for nevrotransmittere i CSF. Dette vil gi forbedret diagnostisk tilbud og bidra til kvalitetshevende tiltak for den aktuelle pasientgruppen i Norge.
Analyse av nevrotransmittere kan deles inn i flere grupper. Aminosyrenevrotransmittere er allerede del av en etablert analysemetode for aminosyrer ved avdelingen. Den videre teksten vil derfor omfatte analysemetoder for biogene aminer og pteriner, samt 5-metyltetrahydrofolat (5-MTHF), som også er viktig i utredning av nevrotransmittersykdommer og cerebral folatmangel. Ved Seksjon for medfødte metabolske sykdommer har vi validert og implementert metodene i rutinen (tabell 1).
Hensikten med denne artikkelen er å belyse temaet nevrotransmittere; både generelt om nevrotransmittere, valg av metode og preanalytiske feilkilder som kan påvirke prøveresultatet.
Biokjemi
Biogene aminer og pteriner
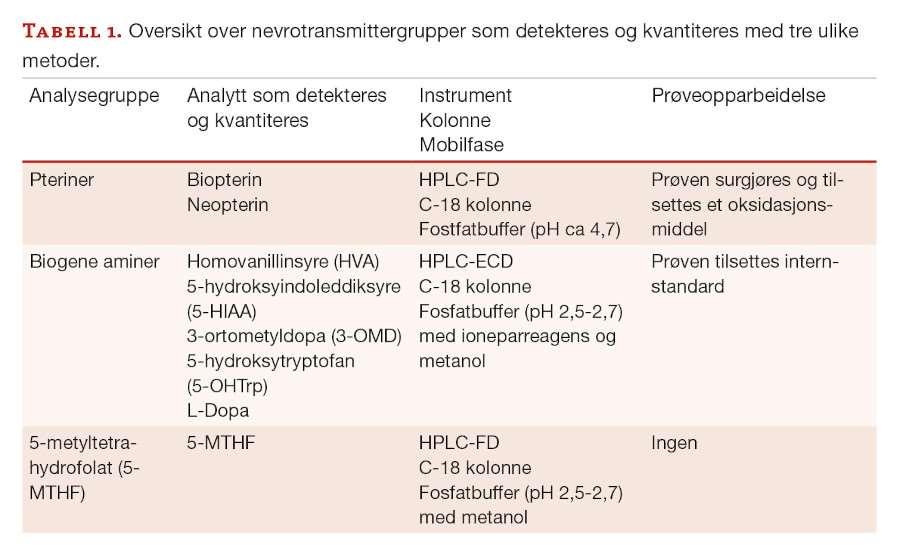
Biogene aminer er ulike signalstoffer som er dannet fra spesielle aminosyrer. Serotonin og dopamin er eksempler på biogene aminer, som er omdannet fra henholdsvis tryptofan og fenylalanin ved hjelp av ulike enzymer. Dopamin omdannes videre til noradrenalin og adrenalin (figur 1).
Dersom det er defekter i genene som koder for enzymene eller defekter knyttet til syntesen av viktige kofaktorer som er nødvendige for enzymenes funksjon, vil man få manglende eller redusert enzymfunksjon. Dette fører til opphopning av stoffer oppstrøms for enzymdefekten og mangel på andre stoffer nedstrøms. Viktige kofaktorer er tetrahydrobiopterin (BH4) og vitamin B6.
Pteriner omfatter blant annet ulike former for biopteriner og neopteriner. Biopteriner eksisterer i biologiske prøver som biopterin og de reduserte formene 7,8-dihydrobiopterin (BH2) og BH4, hvor den sistnevnte er den aktive kofaktoren til enzymene i omdanningen av biogene aminer. Neopteriner finnes som neopterin og dihydroneopterin (NH2). Ved å kvantitere biopterin og neopterin, kan man differensiere mellom ulike pterindefekter.
Det er beskrevet arvelige sykdommer i nesten alle ledd i syntesen av biogene aminer og pteriner (figur 1), men de oppdages sjelden ved vanlig metabolsk screening i blod og urin. Enkelte defekter kan føre til økt mengde av aminosyren fenylalanin, som kan påvises ved nyfødtscreeningen eller ved analyse av aminosyrer i plasma. Prolaktin kan også av og til være forhøyet i blod ved nevrotransmittersykdom. Dette fordi produksjonen styres og hemmes av dopamin, og mangel på dopamin vil da gi nedsatt hemming av prolaktin. Økt vanillyllaktat kan av og til påvises ved analyse av organiske syrer i urin.
5-MTHF
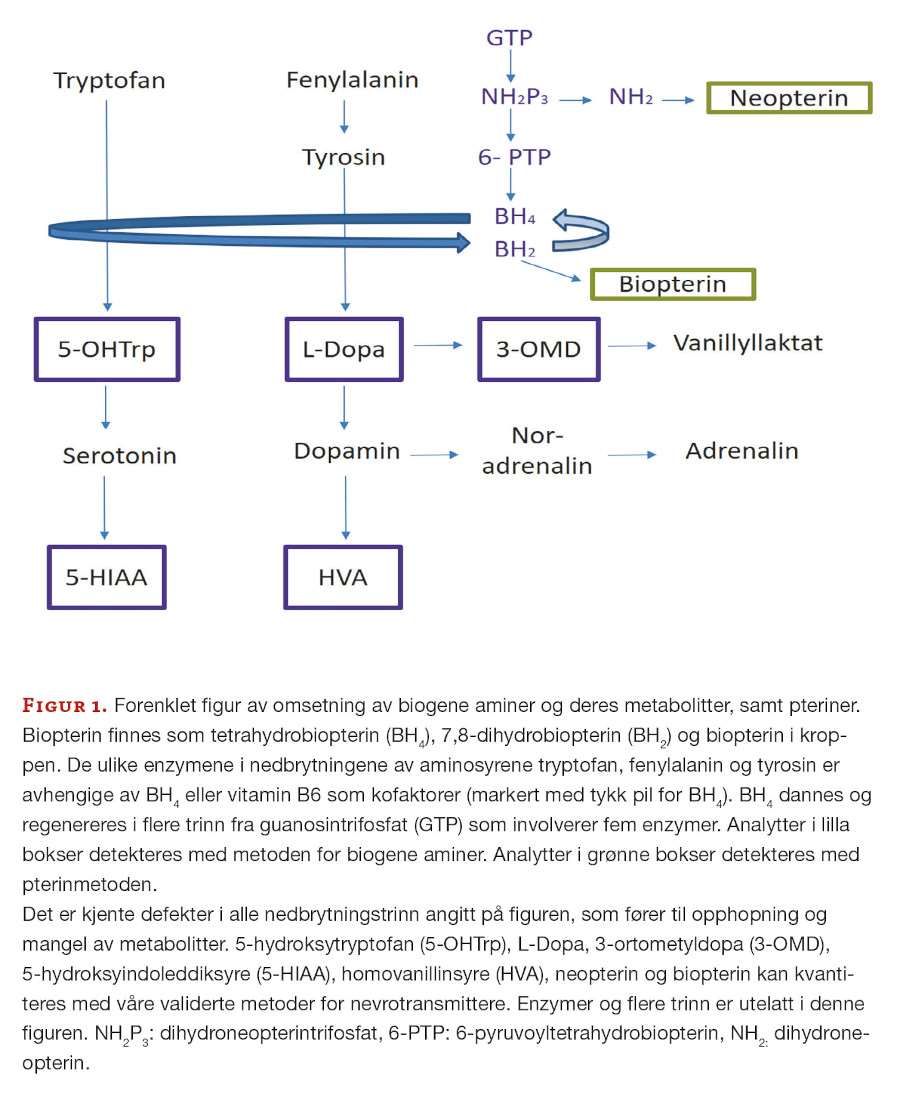
5-MTHF er en aktiv folatkomponent i kroppen og lave verdier kan sees ved flere defekter som samlet sett kalles cerebral folatmangel. 5-MTHF er viktig i ulike prosesser i det sentrale nervesystemet, ved blant annet omdanning av aminosyren homocystein til metionin og produksjon av S-adenosyl-metionin (SAM) (figur 2).
SAM er viktig i over hundre reaksjoner i cellene, inkludert metylering av DNA, RNA, nevrotransmittere og hormoner (1). 5-MTHF kan være lav ved ulike defekter i metabolismen av pteriner og biogene aminer og ved ulike mitokondriesykdommer.
Valg av analysemetoder
Måling av nevrotransmittere i CSF kan være utfordrende på grunn av lave konsentrasjoner (nM) og følsomhet for ulike preanalytiske variabler som beskrives senere i teksten. I de fleste tilfeller deles måling av nevrotransmittere inn i tre analysegrupper, hvor hver av gruppene analyseres med egen metode. Valg av analyseoppsett baseres på tilgjengelige instrumenter og vurdering av analysens sensitivitet og stabilitet.
Biogene aminer
Serotonin og dopamin er kjemisk ustabile, lysfølsomme og utsatt for spontan reaksjon. De omdannes eller tas opp igjen raskt etter frigjøring fra nervecellene, så med vår metode måler vi deres forstadier og endeprodukter, som er mer stabile. Vi analyserer homovanillinsyre (HVA), 5-hydroksyindoleddiksyre (5-HIAA), 3-ortometyldopa (3-OMD), 5-hydroksytryptofan (5-OHTrp) og L-Dopa.
Disse analyttene kan analyseres med væskekromatografi (HPLC- high performance liquid chromatography) med fluorescensdetektor (FD) eller elektrokjemisk detektor (ECD).
Andre muligheter er væskekromatografi med massespektrometri som detektor (LC-MS) eller gasskromatografi-MS (GC-MS). Gullstandard for kvantitering av biogene aminer er HPLC-ECD (2). Metoden er følsom med god linearitet og krever ingen prøveopparbeidelse. Det kreves i tillegg relativt lite kostbare instrumenter. Ulempen med denne metoden er at det tar lang tid å optimalisere og klargjøre systemet før analysestart. HPLC-ECD er metoden vi har valgt å benytte til kvantitering av biogene aminer.
Pteriner
Pteriner kan blant annet analyseres ved hjelp av HPLC-FD eller seriekoblet med både ECD og FD (2). Den sistnevnte metoden er usikker da det er de reduserte pterinene som kvantiteres. Dette er reaktive analytter som oksideres fort, og man kan få falskt for lave resultater. HPLC-FD skiller ikke mellom BH4 og BH2, fordi disse er kun svakt eller ikke-fluorescerende stoffer. Det tilsettes derfor et oksidasjonsmiddel umiddelbart etter at prøven er tint slik at total biopterin måles, inkludert BH2 og BH4. Metoder med LC-MS er også beskrevet, men disse er mindre sensitive enn for eksempel deteksjon med FD (2). Vi valgte å sette opp en metode for pteriner med HPLC-FD, hvor biopterin og neopterin kan kvantiteres.
5-MTHF
Det finnes publiserte metoder for måling av 5-MTHF ved hjelp av LC-MS, HPLC-ECD og HPLC-FD (3). HPLC-ECD er følsom for urenheter i mobilfase og HPLC-systemet. Det er tidkrevende å få stabil baseline, som er viktig å ha når en måler små mengder av en analytt. Vi har erfart at HPLC-FD er en mer robust metode, og siden det tar kort tid før systemet er klart til analyse, valgte vi å benytte denne metoden.
Validering og endelig metode
Tabell 2 viser et utdrag av valideringsresultatene våre. For de ulike analyttene er impresisjon testet for ulike konsentrasjonsnivåer, der høyest oppnådde variasjonskoeffisient (VK) er vist i tabellen.
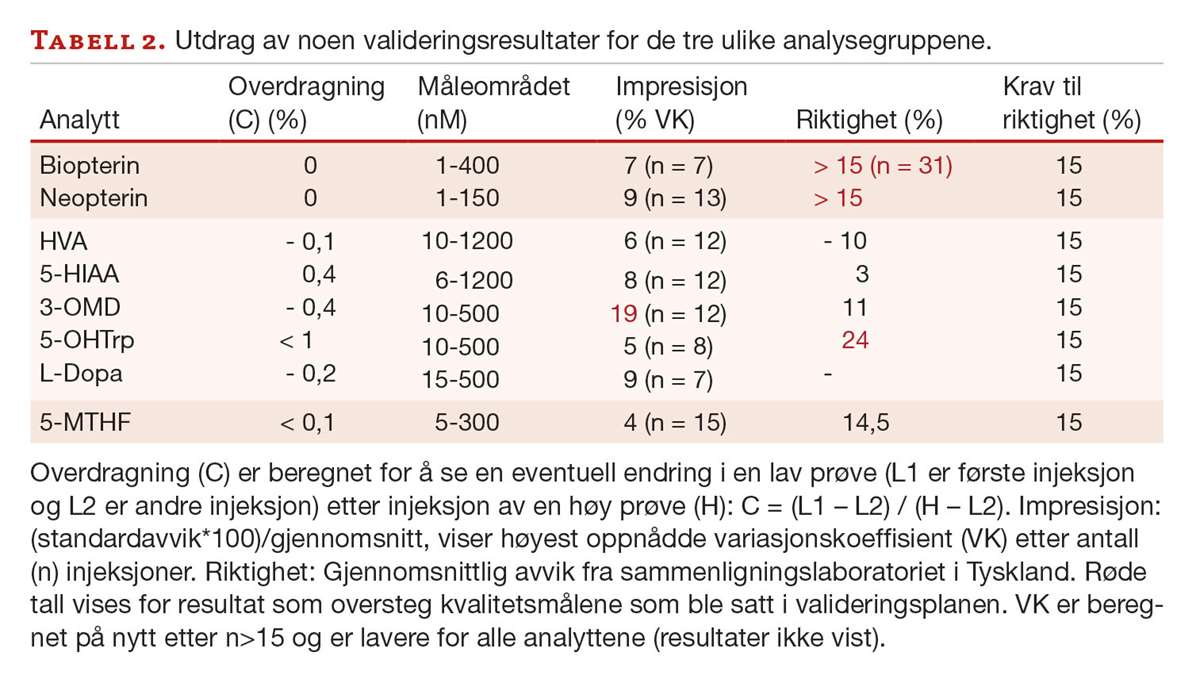
Måleområdet ble bestemt etter uttesting av nedre kvantiteringsgrense og linearitet. Ved hjelp av avdelingens valideringsprotokoll, ble det beregnet relativ riktighet ut ifra sammenligning av prøver analysert både hos oss og ved et laboratorium i Tyskland. Dette gjelder for alle tre analysemetodene. Differanseplott ble vurdert og resultatene ble tolket ved hjelp av regresjon (Deming eller ordinær lineær regresjon (OLR)), samt ratiotest og differansetest basert på t-test. Absolutt riktighet kan ikke måles for 5-MTHF eller pteriner fordi det ikke finnes ekstern kvalitetskontroll/ referansemateriale. Krav til riktighet ble basert på klinisk vurdering satt til lavere enn 15 % avvik for alle analyttene. Overdragning (C) er beregnet for å se en eventuell endring i en lav prøve (L) etter injeksjon av en høy prøve (H): C = (L1 – L2) / (H – L2) (L1 er første injeksjon og L2 er andre injeksjon).
Biogene aminer
Vi benytter HPLC-ECD for separasjon og deteksjon av biogene aminer. Det er ingen prøveopparbeidelse, men det tilsettes internstandard i prøven før den analyseres. Hensikten med internstandard er å korrigere for variasjon i injeksjonsvolum, samt vurdere retensjonstider av analyttene. Mobilfasen, en fosfatbuffer med metanol, tilsettes et ioneparreagens for å optimalisere interaksjon mellom analyttene og C18-kolonnen. Kvantitering skjer ved hjelp av ett-punkts kalibreringskurve. Først i analyseserien analyseres en standard (figur 3a) som inneholder komponentene som skal kvantiteres, etterfulgt av interne kvalitetskontroller og til slutt prøvene. Figur 3b viser en prøve med forhøyet 5-OHTrp og 3-OMD, som kan tyde på en defekt i nevrotransmittermetabolismen.
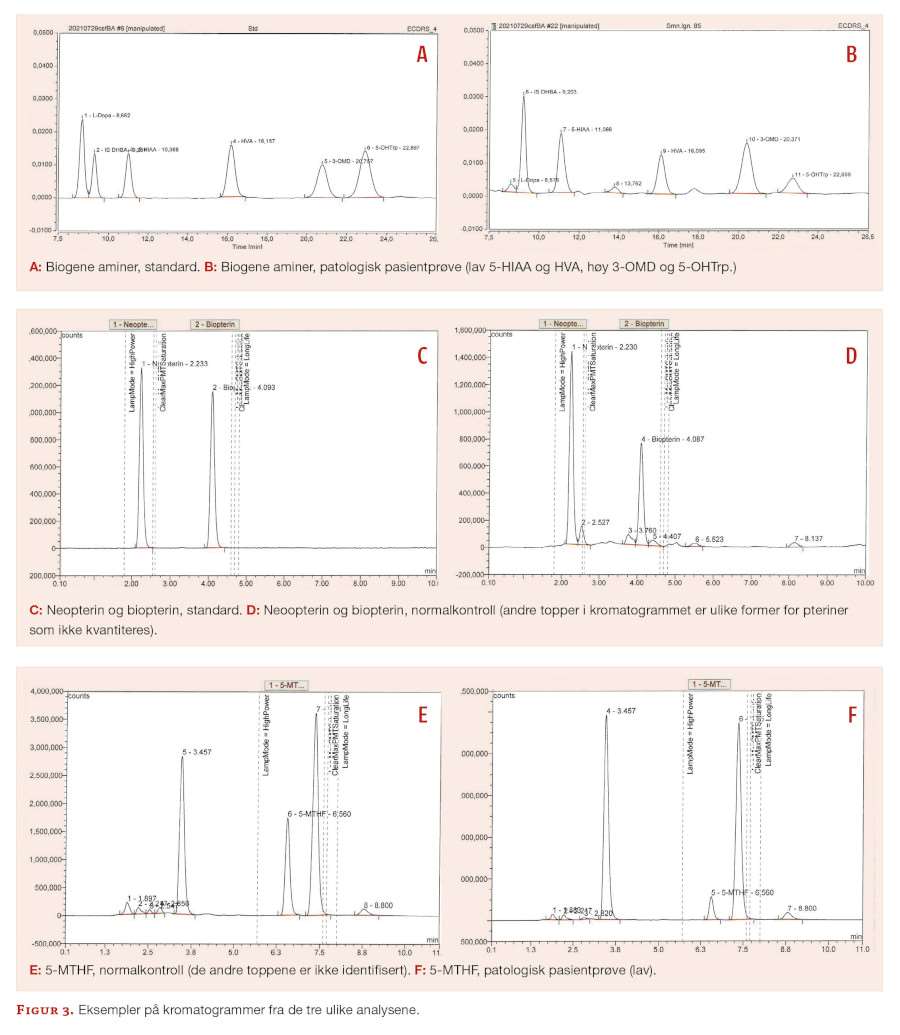
For HVA og 5-HIAA kan resultater både over og under referanseområdet være patologiske, mens kun høye svar for 5-OHTrp, 3-OMD og L-Dopa er klinisk relevant. For å overvåke metoden, deltar vi i det eksterne kvalitetsprogrammet ERNDIM (eksternt kvalitetskontrollprogram for laboratorier som tester for medfødte metabolske sykdommer) hvor vi rapporterer resultat for HVA, 5-HIAA, 3-OMD og 5-OHTrp.
Som del av metodevalideringen ble det sendt prøver til Tyskland for analyse for å vurdere riktighet (tabell 2). I tillegg ble det analysert prøver fra ERNDIM for å beregne riktighet for HVA, 5-HIAA, 3-OMD og 5-OHTrp. Våre resultater er i god overensstemmelse med ERNDIM-resultatene.
Metoden for biogene aminer ble godkjent og implementert i rutinen i juni 2021. Det er kjente avvik med sammenligningslaboratoriet, men siden de ulike resultatene vurderes opp mot hverandre og sammen med pterinresultatene er dette akseptabelt. Det vil bli beregnet nytt referanseområde når det er analysert nok prøver.
Pteriner
Standarder, kontroller og prøver lysbeskyttes så mye som mulig under prøveopparbeidelsen, hvor de reduserte pterinene (BH2 og BH4) oksideres til biopterin ved hjelp av et oksidasjonsmiddel som tilsettes prøven. Analyttene separeres med en C18-kolonne og mobilfasen er en fosfatbufferløsning. Betingelsene for detektoren er optimalisert i forhold til analyttenes eksitasjons- og emisjonsbølgelengder. Biopterin og neopterin kvantiteres mot en ett-punkts kalibreringskurve, og det analyseres interne kvalitetskontroller i hver serie. Kromatogram for standard og en normal prøve er vist i figur 3c og d. Biopterin og neopterin separeres tilfredsstillende fra nærliggende komponenter. Resultater over og under referanseområdet kan være patologiske.
Neopterinverdiene ved vårt laboratorium var lavere enn hos laboratoriet i Tyskland. For biopterin ga svar < 15 nmol/L høyere svar hos oss, men svar > 15 nmol/L ga lavere svar. Vi så imidlertid systematisk avvik (resultat ikke vist) og referanseområdet ble derfor justert. Prøver fra pasienter med kjent nevrotransmitterdiagnose ble ekskludert fra beregningen av justert referanseområde.
Metoden for kvantitering av pteriner ble validert og implementert i rutinen i juni 2021. Det vil bli beregnet nytt referanseområde når det er høstet nok data. Denne metoden er rask og enkel i bruk og krever ikke dyr instrumentering. Interne kvalitetskontroller viser god reproduserbarhet med impresisjon som tilfredsstiller krav satt i valideringsprotokollen.
5-MTHF
5-MTHF analyseres med HPLC-FD og kvantiteres med en ett-punkts kalibreringskurve. Mobilfasen er en surgjort fosfatbuffer og analytten separeres på en C18-kolonne. Det er ingen prøveopparbeidelse og det analyseres en standard og interne kvalitetskontroller i hver serie. Kromatogrammer for normalkontroll og en pasientprøve med patologisk lav konsentrasjon er vist i figur 3e og f.
Beregning av riktighet for 5-MTHF ga i gjennomsnitt 14,5% avvik fra sammenligningslaboratoriet (tabell 2). Avviket var ikke systematisk, og ingen korrigeringsfaktor blir benyttet ved svarutgivelse. Foreløpig benyttes referanseområdet til sammenligningslaboratoriet. Verdier under nedre referansegrense kan tyde på sykdom, og videre utredning anbefales.
Metoden er spesifikk og sensitiv nok til å detektere lave mengder 5-MTHF i CSF. Dette bidrar til at pasienten kan få riktig diagnose, i tillegg til at vi kan monitorere pasienter under behandling. Metodevalideringen for 5-MTHF ble godkjent og implementert i rutinen i januar 2020.
Referanseområder
For både biogene aminer og 5-MTHF benyttes referanseområder fra sammenligningslaboratoriet, inntil nye referansegrenser kan beregnes ved vårt laboratorium. Dette tar tid for disse analysene, fordi det er få pasienter som utredes for nevrotransmittersykdommer. Det er nødvendig med aldersrelaterte referanseområder for biopterin, HVA, 5-HIAA 3-OMD og 5-MTHF, siden verdiene er høyere i nyfødtperioden og faller raskt med økende alder (4). Det kreves > 30 prøver innen hvert alderstrinn før det kan beregnes nytt referanseområde.
Alle analysesvar vil følges opp av medisinsk faglig ansvarlig, som vurderer eventuell videre utredning (for eksempel nevrotransmitter-genpanel).
Prøvetaking og preanalytiske variabler
Ved prøvetaking for analyse av nevrotransmittere må spinalvæsken fryses umiddelbart (bedside) på tørris. Hvis spinalvæsken er blodtilblandet, skal prøven først sentrifugeres. Prøven må oppbevares i -70 °C og sendes på tørris. Man må bruke prøveglass uten tilsetning, gjerne 1.5 mL mikrorør, og tappe 10 dråper (0.5 mL) per glass. Hvert glass må merkes med pasientidentifikasjon og fraksjonsnummer (nummer i rekken glasset er tatt). Fraksjon 1 kan ikke benyttes på grunn av risiko for kontaminering med blod. Fraksjon 2-5 skal benyttes til disse analysene.
Før pasientene spinalpunkteres, er det viktig at alle som er involvert i prøvetakingen (både lege, sykepleier og bioingeniør) kjenner til de ulike feilkildene som kan påvirke analyseresultatene.
Biogene aminer
I CSF er det en konsentrasjonsgradient av HVA og 5-HIAA, som betyr at konsentrasjonen stiger jo mer CSF som blir tappet. For at analysesvarene skal bli korrekt vurdert, er det derfor viktig å analysere biogene aminer i samme fraksjon for alle pasienter.
Hemolyse kan føre til falskt for lave verdier av HVA og 5-HIAA, trolig som følge av autooksidasjon. Ved innstikksblødning må spinalvæsken derfor sentrifugeres og avpipetteres umiddelbart etter prøvetaking før den fryses.
Biogene aminer er stabile i 24 timer ved 4 °C, men siden pteriner og 5-MTHF er svært ustabile må prøven settes umiddelbart på tørris og lagres ved -70 °C.
Behandling med noen medikamenter kan påvirke konsentrasjonen av biogene aminer, og derfor må medikamentbehandling påføres rekvisisjonen (4).
Pteriner
Pteriner er svært reaktive i kontakt med lys og oksygen og kan raskt omdannes til andre stoffer (5). Derfor er det nødvendig at prøvene settes direkte på tørris etter prøvetaking og flyttes til -70 °C- fryser så fort som mulig. Det er ikke nødvendig med ekstra lysbeskyttelse rundt glasset, da boksen med tørris må ha lokk. Men dersom spinalvæsken må sentrifugeres på grunn av blodtilblanding, må prøveglasset lysbeskyttes med aluminiumsfolie ved transport til sentrifugen.
5- MTHF
5-MTHF er ustabil og verdien kan falle ved oppbevaring ved feil temperatur (6). Det er derfor viktig at CSF settes direkte på tørris etter prøvetaking. Prøven må lagres ved -70 °C inntil den sendes til laboratoriet. Blodig CSF vil gi falskt for høyt resultat på grunn av høyere konsentrasjon av 5-MTHF i erytrocyttene (7). Dette kan resultere i oversett diagnose, så prøver med blodtilblanding avvises derfor for denne analysen. Det må spinalpunkteres før behandlingsoppstart med folininsyre. Dersom det kun skal analyseres 5-MTHF, kan alle fraksjoner med unntak av den første benyttes.
Avslutning og videre arbeid
Nevrotransmittersykdommer er sannsynligvis underdiagnostisert i Norge. Det arbeides med å informere sykehusavdelinger i landet om hvilke analyser vi kan tilby. Det er opprettet ny rekvisisjon til analyse av nevrotransmittere, hvor informasjon angående prøvetakingen er tydelig merket. Bioingeniører på prøvemottak er ansvarlig for å motta og sende CSF-prøvene til oss ved Seksjon for medfødte metabolske sykdommer. Dersom det ikke tas hensyn til preanalytiske feilkilder, har måling av nevrotransmittere liten hensikt og kan i verste fall føre til feil eller mangelfull diagnose.
Takk
Takk til Elise Mørk Sandås, som har bidratt til å sette opp analysemetoden for pteriner. Stor takk til Mari Oppebøen, barnelege, OUS, samt Nasjonal kompetansetjeneste for sjeldne diagnoser, for midler til frikjøp av Therese Marvik Dahl.


