Historikk
På begynnelsen av 1970-tallet oppsto det en ”epidemi” blant barn i noen kommuner i Connecticut på østkysten av USA. Det var uvanlig mange, faktisk en tiendedel av barna i byen Old Lyme, som fikk diagnosen juvenil reumatoid artritt. Den nyutdannede rheumatologen Allen C Steere fra Yale University ble satt på oppgaven for å finne årsaken til denne uvanlige tilstanden. Normalt er det ikke mer enn 1/100 000 barn som får denne diagnosen. Steere fant ut at det var en sesongvariasjon, med flest tilfeller på sommer og tidlig høst. Hos ca 25 prosent av barna hadde det vært et rødt utslett, som siden vokste til å bli stort og sirkulært i forkant av leddplagene. Det var særlig de store leddene som var affisert, og plagene var asymmetriske hvis flere ledd var involvert. Det var oftest kneet som var involvert i leddplagene. Det ble antatt at et insekt var årsak til utslettet, men dyrkning av synovialvæske fra leddene og serologiske tester var alle negative. Etter stedet hvor disse observasjonene ble beskrevet, ble sykdommen så kalt Lyme disease (1).
På begynnelsen av 1980 tallet undersøkte Willy Burgdorfer flått fra Shelter Island, på jakt etter Rickettsia. I stedet fant han ut at cirka 50 prosent av flåttens tarm var infisert med en spiralformet bakterie. Det ble videre utviklet vekstmedium for å dyrke bakterien. Det viste seg at pasienter som hadde fått diagnosen Lyme disease hadde høyt antistofftiter mot denne spiroketen som var dyrket i kultur (2). Bakterien har fått navnet Borrelia burgdorferi, oppkalt etter Willy Burgdorfer, som fant bakterien første gang, og sykdommen kalles nå Lyme borreliose.
Lyme borreliose har de senere årene økt kraftig i omfang både i USA og Europa, og dette skyldes flere faktorer, både gjengroing av kulturlandskap, økning i hjortedyrbestanden, mildere klima og det at mennesker tilbringer mer tid ute i naturen (3).
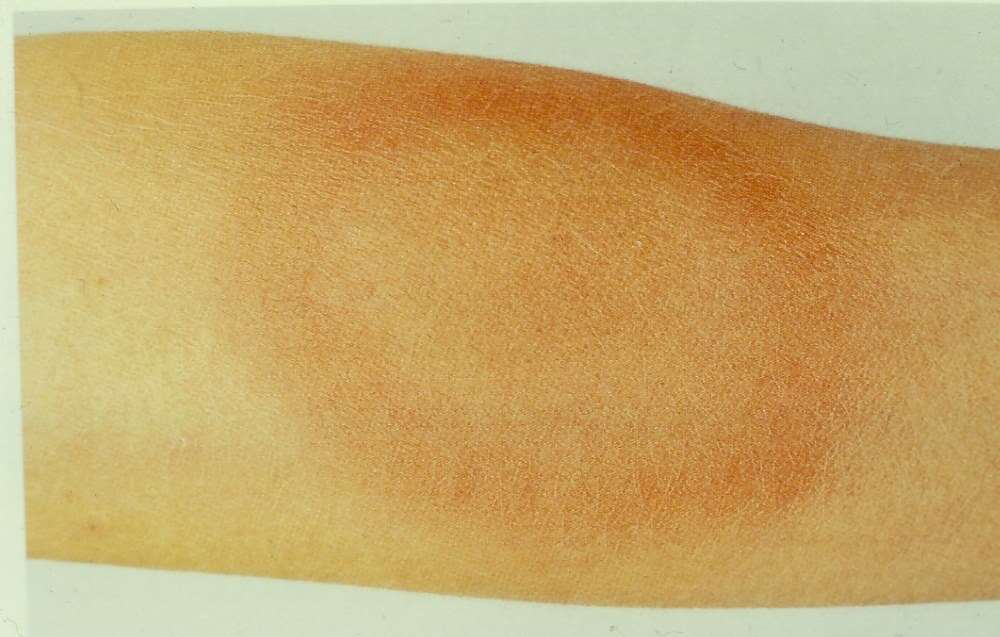
I Europa var imidlertid forskjellige manifestasjoner av Lyme borreliose allerede beskrevet, av svensken Afzelius i 1910 og østerrikeren Lipschutz i 1913. De beskrev hudlesjonen, det ekspanderende røde sirkulære utslettet erythema migrans (EM) (figur 1), som kunne relateres til flåttbitt. Dette var det samme som Allen Steere beskrev på midten av 1970-tallet.
Herxheimer og Hartmann karakteriserte et annet hudutslett som kunne forbindes med flåttbitt, det kroniske rød-blå utslettet acrodermatitis chronica atrophicans (ACA) allerede i 1902. Garin og Bujadox i 1922 og Bannwarth i 1941 beskrev neurologiske manifestasjoner i forbindelse med flåttbitt, senere kalt Bannwarth syndrom. Bäverstedt presenterte i 1943 en stor studie av benign kutan hyperplasi (lymphocytoma). I 1948 beskrev Lennhoff spiroketlignende strukturer i hudbiopsier fra mange ulike hudlidelser, inkludert erythema migrans. Lennhofs observasjoner førte til bruk av penicillin for å kurere erythema migrans i Europa (4).
Borrelia burgdorferi
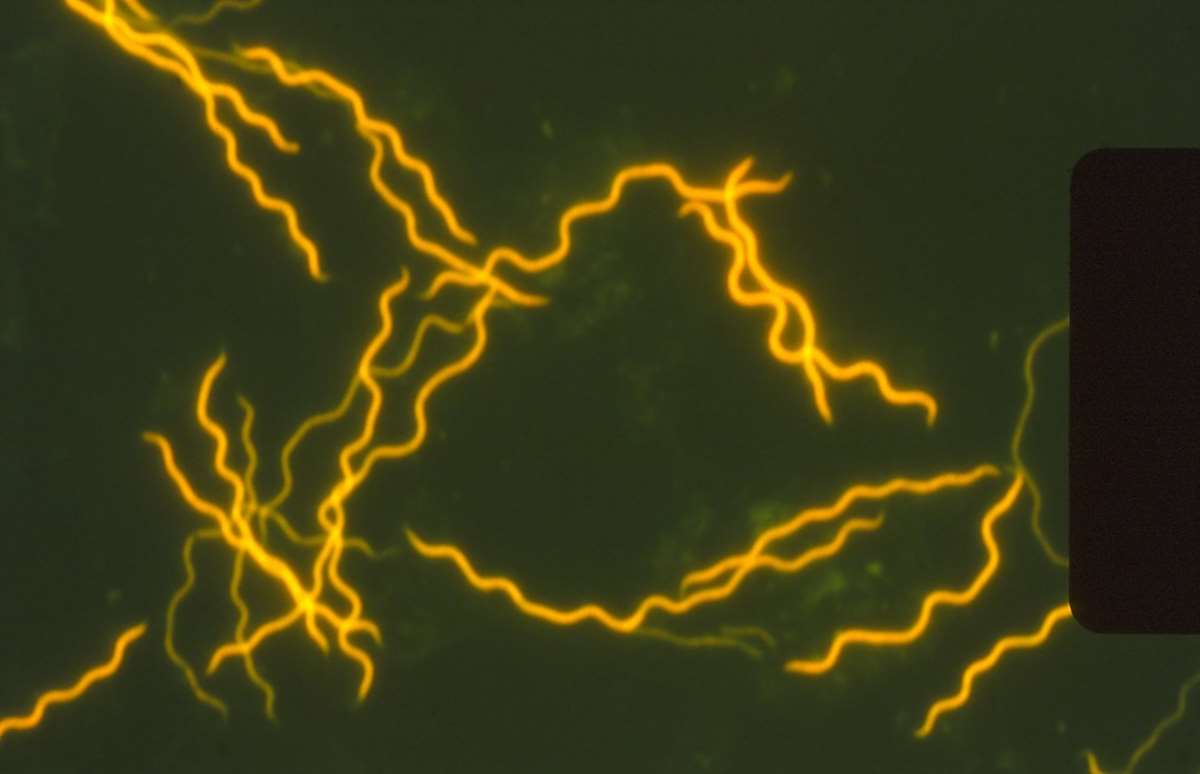
Borrelia burgdorferi sensu lato, som er årsaken til Lyme borreliose, kan deles inn i minst ti ulike genospecies, men denne multisystemsykdommen er vanligvis forårsaket av de tre genospecies av B. burgdorferi sensu lato: B. afzelii, B. garinii, og B. burgdorferi sensu stricto (5). Bakterien er en gramnegativ bevegelig spiroket som måler 0,18-0,3 x 15-30 μm, er spiralsnodd og har 7-11 periplasmatiske flageller som er festet i hver ende og går til midten av bakterien hvor de overlapper hverandre (figur 2). De unike flagellene tillater bakterien å bevege seg i viskøs væske, en egenskap som er viktig for å disseminere til fjerntliggende områder (6). Bakterien varierer fra å være mikroaerofil til anaerob, avhengig av genospescies og type (7).
En av de mest slående egenskaper hos B. burgdorferi er det uvanlige genom som består av et lineært kromosom på 910 kilo basepar (kbp), tolv lineære og ni sirkulære plasmider som varierer i lengde fra 5-54 kbp. Det er ikke kjent at andre bakterier har så mange plasmider per celle. Mange av plasmidene kan mistes i kultur, men de resterende ansees som svært viktige for bakterien, og kalles gjerne ”minikromosomer”. På alle DNA-endene av kromosomet er det dannet ”covalently-closed hairpin telomeres”, og dette er ikke kjent fra andre cellulære organismer. Lineært genom er også uhyre uvanlig blant mikroorganismer. Bakteriens genom inneholder blant annet gener for hemolyse, DNA-reparasjon og antibiotika efflux proteiner. Bakterien inneholder ingen gener for cellulær biosyntesereaksjoner, det forklarer hvorfor bakterien må ha et meget komplekst medium for vekst. Bevegelighet synes å være svært viktig for B. burgdorferi, siden bevegelighetsrelaterte gener opptar over seks prosent av genomet.
Noen av plasmidene koder for proteiner som er viktige virulensfaktorer, blant annet det lineære plasmidet lp-28 som koder for antigen variasjon.
Mange av bakteriens gener er kodet for å produsere lipoproteiner. Disse genene er for det meste plassert på plasmider, og proteinene er plassert på bakteriens overflate hvor de kan komme i kontakt med verten. Noen av disse ytre membranantigenene er viktige for bakterien og kalles OspA-F og protein 100 (8).
Epidemologi
Lyme borreliose har vesentlig blitt rapportert fra den nordlige hemisfære i USA og Europa, men Asia og Nord-Afrika har også etter hvert rapporterte tilfeller. I Europa er det Ixodes ricinus som er hovedårsaken til borreliasmitte, mens det i USA i hovedsak er Ixodes dammini på østkysten og Ixodes pacificus på vestkysten.
Lundelusa Ixodes uriae er også bærer av B. garinii. Det er derfor mulighet for at også sjøfugl kan være en smittespreder.
I Norge er flåtten Ixodes ricinus (figur 3) utbredt spesielt i de kystnære områder fra svenskegrensa til Helgeland, men de milde vintrene de senere årene har ført til en fast bestand i innlandet også. Det er spesielt smågnagere og fugler som er reservoaret for B. burgdorferi, og det er en gjensidig smitte mellom flått og smågnagere og fugler hver gang flåtten må ha seg et blodmåltid. Sånn må det være for at den skal kunne utvikle seg fra det ene stadiet til det neste; fra larve til nymfe til voksen. Denne syklusen tar vanligvis to - tre år. Flåtten har ikke øyne, men kan sanse varme, CO2 og smørsyre, og på den måten merke når det er et varmblodig dyr i nærheten som den kan suge blod av. Flåtten skiller ut et bedøvende enzym når den skal suge blod, og det er sannsynligvis årsaken til at bare cirka 50 prosent av infiserte mennesker kan huske at de er blitt bitt. Flåtten må som regel sitte på minst ett døgn for at bakterien skal overføres, men i Europa kan smitte etter noen timer også forekomme. Andre insekter som klegg og stikkmygg kan også være bærere av spiroketen (9).
Patogenese
Det sikreste bevis for en Borrelia infeksjon er det ekspanderende sirkulære røde utslett som kalles erythema migrans. Uheldigvis er det mange (cirka 50 prosent), som ikke utvikler dette typiske utslettet. Ukarakteristiske utslett kan oppstå og føre til problemer med å diagnostisere sykdommen, eller det kan være forsinket utvikling av utslettet fra det normale (2 - 30 dager) til 100 dager etter bitt med smitte av B. afzelii (10). Dette kan da føre til at sykdommen behandles i en sen fase eller ikke i det hele tatt, og dermed fører til kronisk infeksjon. Oftest er det hud, muskler, skjelett, sentrale og perifere nerver, hjerne, hjerte og ledd som affiseres, men det kardiovaskulære system, nyrer, lever, bronkier, lunger, lymfatiske system, øyne, genitalia og mage/tarm affiseres også. Dessuten kan alle vev og organer infiseres, da bakterien raskt kan disseminere til fjerntliggende steder (6,11).
De ulike genospesies av B. burgdorferi sensu lato har ulik tropisme til forskjellig vev, og dette vil ofte føre til forskjellige manifestasjoner. B. afzelii fører oftest til ulike hudmanifestasjoner, B. garinii til nevrologiske symptomer og B. burgdorferi sensu stricto til leddproblemer, men alle tre genospecies kan gi alle symptomer (5).
Den tidlige formen av infeksjonen med utslett kalles gjerne stadium I. Bakterien har stor evne til å migrere i blod og vev, og når fjerntliggende steder blir infisert, gjerne etter noen få uker til måneder etter bittet, kalles gjerne infeksjonen stadium II. Har infeksjonen vart mer enn ett år, blir den betegnet som kronisk, eller stadium III. Det er imidlertid mer vanlig etter hvert å benevne infeksjonene for tidlige eller sene.
Etablering av infeksjon
Binding til vertens vev er det første skrittet for å etablere en infeksjon. Proteoglycanmolekyler som uttrykkes på vertens celleoverflate, registreres av Borrelia, og fører til binding i ulik grad, avhengig av de ulike genospecies. To av bakteriens lipoprotein (decorin bindende protein A og B) binder seg til decorin, et proteoglycan som ”dekorerer” collagene fibere. Bakterien har også evne til å binde seg til dermatansulfat, heparin, integrin og fibronectin (12).
Da B. burgdorferi er en invasiv bakterie vil den dra fordeler av å bruke vertens plasminogenaktiveringssystem for å øke evnen til invasivitet, ved å degradere oppløselige og uoppløselige komponenter av vertens extracellulære matrix (13). B. burgdorferi induserer også matrix metalloproteinase hos nerveceller og astrocytter, som antakelig spiller en rolle når det gjelder symptomer og patogenese ved Lyme borreliose (14). Det ytre overflatemembranprotein A (OspA), er en plasminreseptor, og den proteolytiske aktiviteten på celleoverflaten kan beskytte mot både komplement og spesifikke antistoff (15).
For å etablere infeksjon i mus må spiroketen uttrykke 116 av de 137 lipoproteingenene, innen ti dager etter bittet. 17 - 30 dager etter infeksjonen er bakterien, på grunn av vertens immunrespons, tvunget til å nedregulere mesteparten av lipoproteingenene (16). Det er også vist at Lymespiroketen bruker feromoner som en viktig mekanisme til kommunikasjon, for å kontrollere proteinproduksjon, og dermed for å koordinere ulike funksjoner (17). Hvis bakterien utnytter disse egenskapene kan det lett føre til kronisk infeksjon.
Komplement resistens
B. burgdorferi produserer mange forskjellige såkalte Erp-proteiner på sin ytre membran. Dette ytre overflatemembranproteinet, protein E (OspE), kan binde humant komplementhemmende molekyl, faktor H og faktor H-lignende protein, og på denne måten omgå den alternative komplementveien hos verten (18). Alle B. afzelii er resistente, B. burgdorferi sensu stricto er helt eller delvis resistent, mens B. garinii er hovedsakelig følsomme, bortsettsett fra type 4. Tross dette er noen komplementfølsomme B. garinii blitt isolert fra spinalvæske. Hver av de ytre overflatemembranproteinene, Erp proteinene, uttrykker variabel affinitet for komplement inhibitorer fra forskjellige dyrearter, og kan dermed motstå komplementmediert drap og fagocytose hos hvilket som helst av de potensielle vertene som bakterien eventuelt infiserer.
Antigen variasjon
B. burgdorferi foretar mutasjoner og rearrangementer som kan føre til antigenvariasjon under infeksjonen. Det er særlig OspE som gjennomgår de store antigene variasjonene (19). Dette er en effektiv måte å motstå vertens antistoffangrep. Modifisering og nedregulering av andre ytre overflate proteiner (OspA,C) slik at de ikke bindes til beskyttende antistoffer, er også egenskaper som bakterien bruker for å omgå vertens forsvar. Dette er særlig viktig for bakterien tidlig i infeksjonsfasen.
Oksydativt stress
En av de mange utfordringer som bakterien utsettes for under infeksjonssyklusen er de svært toksiske reaktive oksygen- og nitrogenforbindelsene (ROS). Virulente stammer av B. burgdorferi bruker et transferrinbindende protein for å skaffe seg jern fra det jernfattige miljøet hos pattedyr. Dette jernet kan brukes i det jernholdige superoksyddismutase (FeSOD), som en forsvarsmekanisme mot superoksyd under mikroaerofilt miljø og mot intracellulært oksygendrap. Bakterien kan også føle det oksydative stresset via en transkripsjonsaktivator, som aktiverer stressrelaterte gener for transkripsjon av viktige oksydasjonsstressenzymer (20).
Immunkompleks
Sirkulerende immunkompleks er en sikker serologisk parameter både i tidlig og sen Lyme borreliose, og forhøyede verdier var en av de tidligste immunologiske fenomenene som ble beskrevet ved Lyme disease (21). Immunkompleks kan finnes både i serum, spinalvæske og synovial væske. Når sirkulerende immunkompleks er av en størrelse og en kvantitet som ikke blir fjernet tilstrekkelig av det retikuloendoteliale system, avsettes de i vev og organer og aktiverer komplement, noe som videre kan føre til lokal inflammatorisk vevsdestruksjon (22). Immunkomplekser kan også medvirke til å forandre vertens forsvarsmekanisme via defekt Fc reseptor, slik at opsoniserte B. burgdorferi ikke kan fjernes av monocytter (23). Dette er en av årsakene til kronisk klinisk manifestasjon.
Blebs (vesikler)
B. burgdorferi er kjent for å produsere blebs, via sekresjon fra den ytre membran. Antigenene OspA,B,D og protein-100, er inkorporert i disse blebs og har affinitet til endotelceller. For at bakterien skal kunne overleve i det sirkulatoriske system, er det sannsynlig at fjerning av blebs (og dermed overflateantigener) er fordelaktig. Blebs inneholder også en mitogen faktor for B-lymfocytter, som stimulerer til IgM-produksjon (24).
Mye oppmerksomhet er blitt rettet mot OspA. Dette er et helt spesielt protein som ikke er funnet ellers i naturen. Dette proteinet har mange spesielle egenskaper. Det kan blant annet aktivere nukleærfaktor-kB og indusere mange cytokiner, adhesjonsmolekyler og nitrogenoksyd.
En markert økning av OspA reaktive CD+ T celler er også identifisert i inflammatoriske ledd hos antibiotikaresistente pasienter med Lyme artritt og i spinalvæske hos pasienter med nevroborreliose. Bakteriens liposomlignende vesicler (blebs) vil bli inkorporert i cytosol og i kjernene til dendrittiske celler, lymfocytter og fibroblaster. Dette fører til generering av CD8+ T-celler, som vil kunne drepe visse celler, og dermed være ansvarlig for den autoimmunlignende tilstanden ved Lyme disease (25).
Vertens svar på infeksjon
Lymfokin produksjon
Lipooligosakkarid og det potente pyrogene peptidoglykan i B. burgdorferi og produksjon av sirkulerende immunkompleks medvirker for en stor del til patogenesen i Lyme borreliose. Det produseres inflammatoriske faktorer som interleukin-1 beta (IL-1 β) og tumor nekrose faktor alfa (TNF-α). Bakterien aktiverer også forskjellige celler til å produsere IL-1 β, TNF- α, interleukin-6 (IL-6) og interleukin-8 (IL-8). Det er vist en øket Borrelia spesifikk sekresjon av interferon-gamma (INF-γ), og en svært nedsatt sekresjon av interleukin-4 (IL-4) i spinalvæske ved neuroborreliose (26). Dette kan føre til vevsdestruksjon, sekundert til immunrespons.
Naturlige draps-celler (NK celler)
B. burgdorferi kan indusere en fire ganger økning i antall CD 16 NK-celler, men gir også en alvorlig hemming av NK-cellenes cytotoxiske evne, muligens på grunn av en aktiv spiroketmetabolisme (27). Dette i kontrast til andre bakterier som er kjent for å aktivere NK-celler. Det er også vist at en annen undergruppe av NK celler, CD 57 lymfocytter, er kraftig nedregulert ved kronisk Lyme disease på grunn av cytokinet INF-γ, IL-2 og TNF-α. Dette fører til immunologisk defekt (28).
Diagnostikk
Serologi, (enzyme-linked immunosorbent assay (ELISA), immun fluorescens (IF)), polmerase chain reaction (PCR) og dyrkning, er viktige verktøy for å stille en sikker diagnose om Lyme borreliose, men alle disse metodene har store mangler, og falske negative og positive svar forekommer hyppig (29-33). Spesifikt Borrelia antistoff bundet i sirkulerende immunkompleks, er ofte en årsak til lav sensitivitet for ELISA og Western blot, både i tidlig og sent forløp av sykdommen (21, 34). Siden den antigene heterogeniteten til de ulike stammene er svært stor, kan en årsak til lav sensitivitet være at bare en stamme av B. burgdorferi sensu lato blir brukt i de ulike ELISA eller Western blot. En annen årsak kan være at bakterien aktivt fester seg til, invaderer og dreper humane T og B lymfocytter og dermed hemmer antistoffproduksjon (35). Bakterien er dessuten fakultativ intracellulær og har evnen til å dekke seg med vertens antigen (36). Nylig ble det utviklet en ny IgG ELISA som bruker et syntetisk peptid fra den konserverte delen av OspE (IR6) hos spiroketen. Dette er en test som det ble hevdet hadde høy sensitivitet og spesifisitet, uavhengig av stamme. Det ser nå ut til at også denne testen har variabel sensitivitet i forhold til tidlig og sen infeksjon, og i forhold til hvilken stamme som gir infeksjon (37).
Nylig viste en studie på dyrkningspositive spinalvæsker en slående forskjell på serologi og andre laboratorieparametere, når den infeksiøse stammen var B. garinii eller B. afzelii. Den sistnevnte ga diffuse symptomer, var ofte antistoff negativ, og i spinalvæsken var det normalt antall eller få celler og ofte normal mengde protein (38).
PCR og dyrkning kan være nyttig når det gjelder leddveske og biopsi fra erythema migrans, men ellers har de to metodene meget lav sensitivitet og egner seg ikke i diagnostikken. Noe av årsaken til den lave PCR-sensitiviteten kan være det lave antallet bakterier fra de ulike områdene. Det har også vist seg at ulike primere må benyttes til de ulike kroppsmaterialene for å få positivt resultat. Den praktiske nytten av dyrkning er begrenset, da mediet har variabel kvalitet, inkubasjonstiden er lang og prosessen er arbeidskrevende.
Behandling
Hvis ikke infeksjonen behandles tidlig, kan Lyme borreliosis utvikle seg til en kronisk infeksjon. Fjorten dagers behandling med penicillin, doxycyklin eller ceftriaxon, er vanligvis antatt å være tilstrekkelig for å kurere infeksjonen. Alle antibiotika som vanligvis blir brukt har imidlertid mangler, og eventuelle tilbakefall kan være avhengig av hvilke antibiotika som brukes og hvilket stadium sykdommen er i. Mekanismen for bakteriens overlevelse er utilstrekkelig forstått, men det at bakterien dekker seg med vertens antigen kan være én årsak. Andre årsaker kan være den intracellulære lokaliseringen og cysteformene (12, 36, 39) (figur 4). Det er nødvendig med mer forskning for å belyse dette.
Bakteriens antibiotikafølsomhet skiller seg både fra gram-positive og gram-negative bakterier, da den er resistent ovenfor aztreonam, teikoplanin, fucidinsyre, fluoroquinoloner, aminoglukosider, cefaclor, loracarbef, ceftibuten, nalidixin syre, trimetoprim-sulfamethoxazole, fosfomycin og rifampicin (40). De stammene som er undersøkt så langt, viser svært variabel følsomhet ovenfor de ulike antibiotika, og den minste konsentrasjon av penicillin G som hemmer (MIC) vekst av B. afzelii er 10 ganger høyere enn for B. burgdorferi sensu stricto og 100 ganger høyere enn for B. garinii (41).
Når Borrelia er lokalisert intracellulært, vil β-lactamantibiotika ikke klare å utrydde bakterien. Tetracykliner og makrolider vil da være mer effektive.
Pasienter som har vært syke i mer enn ett år, kan noen ganger trenge flere måneder, eller gjentatte behandlinger for å bli kvitt alle symptomene. For lave doser av de vanligst brukte antibiotika kan føre til cysteformer som overlever. En kombinasjonsbehandling hvor metronidazole eller hydroxychloroquine inngår, kan da være en fordel (42-45).
Det er nylig vist at høy-volum dyrkning av plasma fra pasienter med erythema migrans, ga oppvekst av spiroketer i mer enn 40 prosent av tilfellene. Dette reiser spørsmål om også infeksjon i tidlig fase bør ansees som disseminert til fjerntliggende steder, og behandles deretter (11).
Det er rimelig å anta at hvis ikke alle former av bakterien, i alle vev og organer, blir drept, er det mulig at sykdommen blusser opp kortere eller lengre tid etter at behandlingen er avsluttet.
Forebygging
Det er særlig de kystnære områdene fra svenskegrensa til Nordland som er mest befengt med flått, men i de senere årene, med milde vintre, har flåtten også etablert seg i innlandet mange steder. Flåtten trives best i tett vegetasjon, i busker, kratt og høyt gress, så noe av årsaken til den økte bestanden de senere årene er gjengroing av kulturlandskapet. Globalt er det også en markant sammenheng mellom den økte flåttbestanden og utbredelse/mengde av hjortedyr, og da særlig rådyr. Men Lyme borreliose har også en sosial faktor. Mer rekreasjon i skog og mark og ved sjøen øker forekomsten av borreliasmitte (3). Vaksine er utviklet mot den amerikanske B. burgdorferi sensu stricto B-31, basert på anti- Osp-A. Denne vaksine hadde imidlertid noen bivirkninger og er trukket tilbake fra markedet. Siden Europa har flere genospecies av B. burgdorferi sensu lato, med ulik Osp-A, ville vaksinen uansett ikke vært effektiv her. Det forskes fortsatt på vaksiner mot de europeiske variantene av bakterien, men ingen er foreløpig kommet i produksjon. Uansett er bakteriens antigene variasjon en utfordring i vaksinesammenheng.
En bør derfor under opphold i flåttbefengt terreng ta visse forhåndsregler, for eksempel bruke lyst tøy, siden den brunsvarte flåtten da lettere kan observeres. Sokker bør trekkes utenpå buksebena, slik at flåtten på sin vandring ikke krabber inn under buksebena. Myggmiddel har noe avskrekkende effekt på insektet. Man bør riste tøyet etter ”farefullt oppdrag”.
Ved bitt bør insektet fjernes så fort som mulig, gjerne med en flåttavtager. Man vrir flåtten en gang rundt og trekker den rett ut. Vanligvis skjer ikke overføring av bakterien før flåtten har sittet på i ett døgn, men i Europa kan smitte skje allerede etter få timer. Hvis det etter to til hundre dager oppstår en rød ring på mer enn fem cm i diameter rundt bittstedet, er man med sikkerhet smittet (10). Hvis man har dette typiske utslettet (erythema migrans) er det unødvendig med antistoffundersøkelser, og man skal alltid behandles.
Imidlertid kan utslettet være atypisk eller helt mangle. Skulle det i etterkant av bittet oppstå diverse plager, fra influensalignende symptomer til hodepine, stiv nakke, leddverk, muskel/skjelett verk, lammelser, kronisk utmattelse eller hjerteproblemer, bør lege kontaktes.
Mange ulike symptomer kan imidlertid oppstå, og Lyme borreliose kalles med rette den nye store ”sykdomsimitatoren”.
Det er viktig å være oppmerksom på at antistoffundersøkelser ofte er negative tidlig i sykdomsforløpet. Ved fortsatt mistanke bør derfor antistofftiter kontrolleres etter fire - seks uker. Uheldigvis er det en del pasienter som av ulike årsaker forblir antistoff negative (12, 21, 29-39), og det kan derfor være nødvendig at en spesialist i infeksjonssykdommer vurderer om symptomene kan relateres til Lyme borreliose.
Det viktigste å huske i forebyggingen er at jo hurtigere en fjerner flåtten, jo mindre er faren for infeksjon, og jo hurtigere infeksjonen blir behandlet, jo større er sjansen for å bli frisk.