FAG resymé
Ei brikke her og ei brikke der – til saman gir dei auka kunnskap om akutt intermitterende porfyri
Kvar brikke er viktig i eit puslespel, for å sjå heilskapen. Gjennom funksjonell og strukturell karakterisering av variantar av hydroksymetylbilan syntase, eit enzym som er assosiert med ein porfyrisjukdom, har vi funne nye brikker som gir meir kunnskap om sjukdomsmekanismen.
Av HELENE BUSTAD JOHANNESSEN
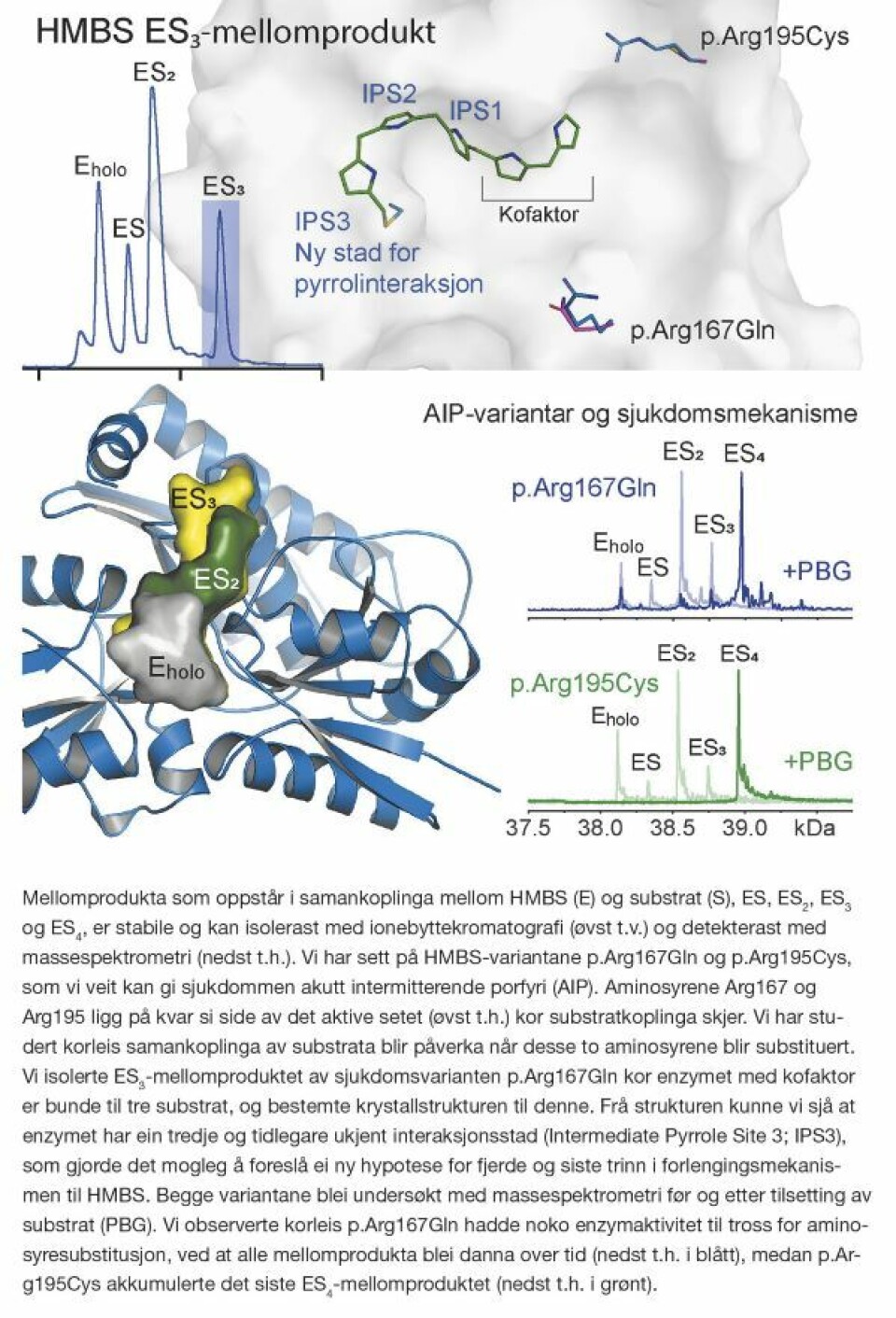
Hem er bygd opp av fire pyrrolringer og blir danna i hemsyntesen av åtte forskjellige enzym. Hydroksymetylbilan syntase (HMBS; også kjent som porfobilinogen deaminase) er det tredje enzymet i hemsyntesen, og koplar saman porfobilinogen (PBG) i fire trinn til ei lineær pyrrolkjede, via kofaktoren dipyrrometan. I denne samankoplinga oppstår det mellomprodukt av enzymet (E) og PBG substratet (S): ES, ES2, ES3 og ES4.
Akutt intermitterende porfyri (AIP)
Variantar av HMBS-genet kan gi HMBS som ikkje er i stand til å omsetje PBG eller å frigjere produktet hydroksymetylbilan (HMB). Desse genfeila er assosiert med akutt intermitterende porfyri (AIP), ein sjeldan og arveleg stoffskiftesjukdom som kan gi alvorlege akutte åtak. Symptoma er i regelen sterke magesmerter som ofte krevjar opioidbehandling, kvalme, takykardi og hypertensjon. Mentale symptom som depresjon og andre psykiske forstyrringar er òg vanleg. Individ med sjukdomsassosierte HMBS-variantar vil ha HMBS med nedsett enzymaktivitet, og hastigheita vil vere avgrensa i dette trinnet i hemsyntesen. Endogene, hormonelle og metabolske faktorar som aukar behovet for hem, vil indusere hemsyntesen i levra. For dei med lågare HMBS-aktivitet enn normalt vil PBG og pyrrolforløparen delta-aminolevulinsyre (ALA) akkumulere. ALA er kjent nevrotoksisk og vil i høge konsentrasjonar kunne utløyse åtak.
To HMBS-variantar som er kjent for å vere assosierte med AIP, er p.Arg167Gln og p.Arg195Cys. Arg167 er ei konservert aminosyre som sit i det aktive setet i enzymet, men utan direkte interaksjonar med kofaktoren. Arg195 er òg ei konservert aminosyre, og denne in-teragerer med kofaktoren. Både Arg167 og Arg195 er truleg involvert i pyrrolforlenginga til HMBS, og aminosyresubstitusjonar her vil påverke funksjonen.
I dette arbeidet har vi studert p.Arg167Gln og p.Arg195Cys, og enzymmellomprodukta som oppstår under samankoplinga av PBG (1). Mellomprodukta kan målast og identifiserast med ulike biokjemiske metodar. Vi har uttrykt rekombinant villtype HMBS og variantar, og nytta enzymaktivitetsanalysar, nativ gelelektroforese, ultra-høgoppløyseleg massespektrometri (ESI FT-ICR MS) og røntgenkrystallografi for å få tak i dei små detaljane rundt funksjonen og strukturen av HMBS.
Ny hypotese
I artikkelen «One ring closer to a closure: the crystal structure of the ES3 hydroxymethylbilane synthase intermediate», har vi tre hovudfunn:
- Gjennom biokjemisk karakterisering av HMBS-variantane p.Arg167Gln og p.Arg195Cys har vi fått informasjon om to variantspesifikke sjukdomsmekanismar på molekylært nivå.
- Vi presenterer krystallstrukturen til mellomproduktet ES3 (PDB ID: 8PND) og viser korleis pyrrolstrukturen trekkjer seg inn i det aktive setet via ein tredje, tidlegare ukjent interaksjonsstad. Dette gir generell informasjon om enzymmekanismen til HMBS.
- Gjennom krystallstrukturen har vi fått indikasjonar på at frigjeringa av produktet kanskje skjer på ein annan stad enn det som ein har trudd til no. Vi presenterer difor ei ny hypotese for kor pyrrolkjeda blir hydrolysert, gjennom å sjå på dei tre aminosyrene Arg255, Glu258 og Arg355, som er i nærleiken av den tredje staden for interaksjon.
Resultat
Oppsummert viser resultata våre at Arg167 er med på å bestemme hastigheita for enzymkatalysen i alle trinna for pyrrolforlenging og produktfrigjering, medan Arg195 i hovudsak er involvert i sjølve frigjeringa av HMB-produktet. Vidare har vi indikasjonar på at HMB-produktet kan kløyvast av ved hydrolyse når hexapyrrolen er fullstendig tilbaketrekt i det aktive setet.
Resultata i denne artikkelen er ein del av det overordna prosjektet PredPor (Prediktorer for sjukdomsaktivitet og langtidskomplikasjonar ved akutt intermitterende porfyri), kor målet er å finne nye markørar og svar på kven i pasientpopulasjonen som treng tettare oppfølging. Funna vi har gjort gir ikkje direkte svar på desse spørsmåla, men er viktige puslespelbrikker som vil nyttast i vidare tolking av pasientprøver og data vi har samla inn i PredPor. PredPor-studien har tidlegare vore omtalt i Bioingeniøren (2).
























