FAG i praksis
HIT happens!
Heparinindusert trombocytopeni (HIT) er en alvorlig og potensielt livstruende komplikasjon ved heparinbruk. Nasjonal behandlingstjeneste for avansert trombocyttimmunologi ved UNN i Tromsø utfører alle laboratorieanalyser som er nødvendig for å stille diagnosen.
Av INGVILD HAUSBERG SØRVOLL, overlege ved Nasjonal behandlingstjeneste for avansert trombocyttimmunologi, Universitetssykehuset Nord-Norge
E-post: ingvild.hausberg@unn.no
Det er selvmotsigende, men likevel sant, at medikamentet heparin som skal forebygge og behandle tromboser i seg selv kan være årsak til tromboser. Heparinindusert trombocytopeni (HIT) er en alvorlig komplikasjon knyttet til heparinbruk, med stor risiko for trombosedannelse.
HIT er forårsaket av antistoffer mot et kompleks bestående av endogen platefaktor 4 (PF4) og tilført heparin. Immunkompleksene bindes til Fc-reseptorer på trombocytter og monocytter slik at disse aktiveres og det dannes protrombotiske mikropartikler som kan føre til trombosedannelse og plateforbruk (1).
Heparin er et antitrombotisk medikament som brukes til forebygging og behandling av tromboemboliske tilstander som for eksempel blodpropp, og ved mer spesielle behandlingsregimer som ekstrakorporal sirkulasjon og hemodialyse. Nest etter blødninger er HIT den klinisk viktigste bivirkningen av heparinbruk.
HIT mistenkes ved nyoppstått trombocytopeni etter nylig påbegynt heparinbehandling med fall i trombocyttall > 50 % fra utgangsverdi, venøse og arterielle tromboser, nekroser i hud der man har injisert heparin eller systemiske reaksjoner ved heparininjeksjoner (2).
Diagnostikken av HIT baserer seg på kliniske observasjoner etter oppstart av heparinbehandling og laboratoriediagnostikk (3). Det finnes flere ulike immunologiske og funksjonelle tester, men det fins ingen enkeltest som har alle de testegenskaper (sensitivitet og spesifisitet) og prediktive verdier som er ønskelige. Det er derfor vanlig at man bygger laboratoriediagnostikken på et utvalg av to eller flere tester.
Nasjonal behandlingstjeneste for avansert trombocyttimmunologi ved UNN i Tromsø tilbyr de nødvendige analysene og mottar prøver fra hele landet for utredning av HIT.
Patogenese
Kompleksdannelse mellom PF4 frigitt fra trombocytter og tilført heparin skjer fordi heparin har større affinitet til PF4 enn til glykosaminoglykaner (GAG) som naturlig er bundet til PF4 (figur 1A og B). Utvikling av antistoffer mot PF4/heparin-komplekset skyldes en ny epitop som dannes etter oppstått konformasjonsendring i komplekset (figur 1C). Det dannes så immunkomplekser bestående av IgG-antistoffer og PF4/heparin som kan binde trombocyttenes Fc-gamma-reseptorer. Dette kan føre til aktivering av trombocytter slik at de frigjør platederiverte prokoagulante mikropartikler som kan forårsake trombosering og forbruk av trombocytter (figur 1D).
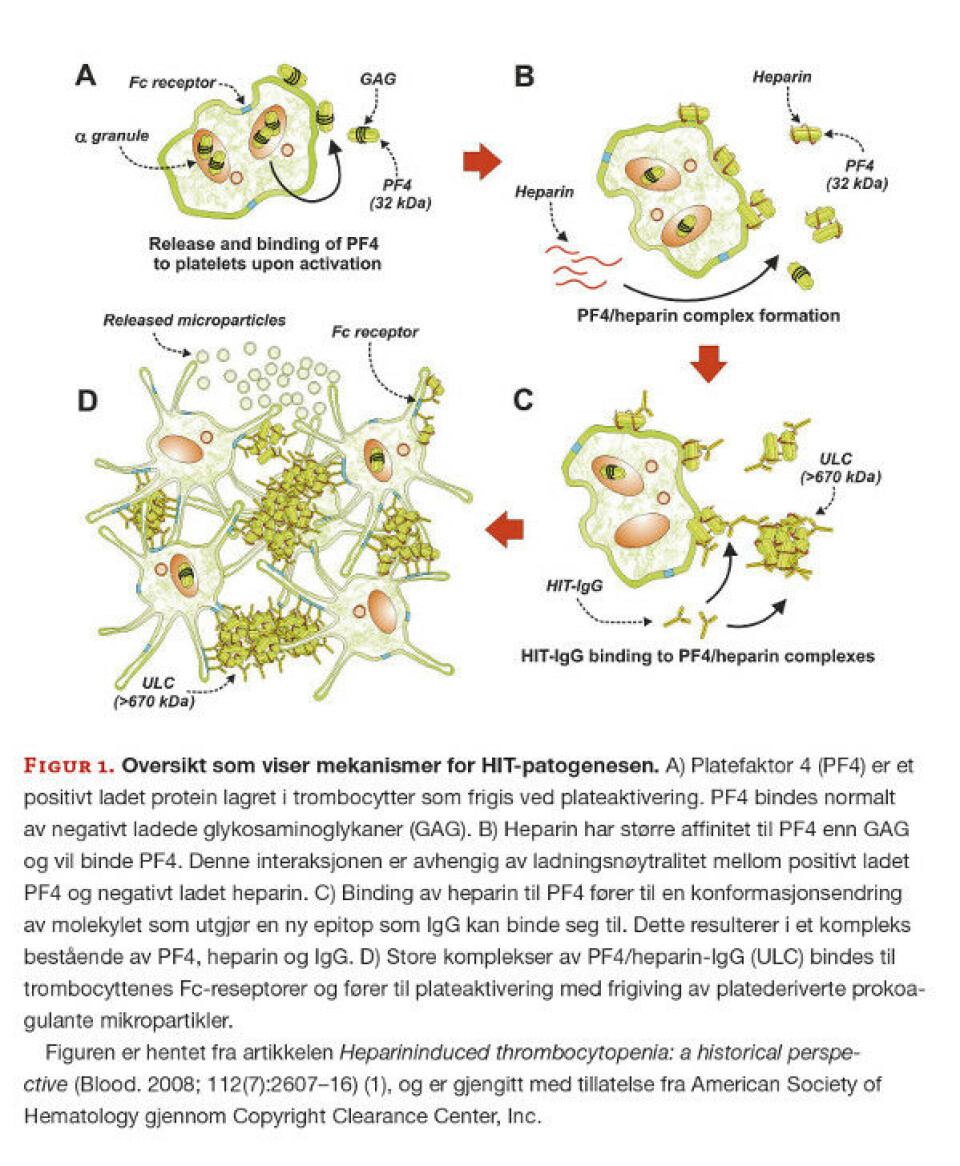
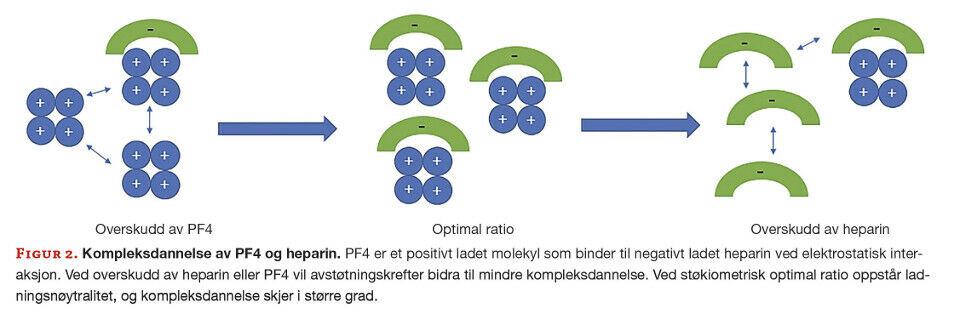
Interaksjonen og kompleksdannelsen mellom PF4 og heparin er avhengig av ladningsnøytralitet (figur 2). Optimal kompleksdannelse oppstår ved lik molar mengde av positivt ladet PF4 og negativt ladet heparin. Overskudd av PF4 eller heparin gir avstøtningskrefter og mindre kompleksdannelse (4). Dette fenomenet benyttes i funksjonelle tester utviklet for diagnostisering av HIT. Heparin i overskudd vil gi nedsatt binding til PF4 og negativt testresultat, mens lavere og mer fysiologiske/terapeutiske doser av heparin vil gi binding og positivt testresultat.
Forekomst
Det er rapportert om insidens av HIT på opp til 5 % hos pasienter som eksponeres for heparin i fire dager eller mer. Metaanalyser viser en absoluttrisiko på 2,6 % ved bruk av ufraksjonert heparin og 0,2 % ved lavmolekylært heparin (5). Denne forskjellen skyldes at ufraksjonert heparin har økt biokjemisk evne til kompleksdannelse med PF4 (6). Ingen dose av heparin er for lav - HIT er sett også ved lave doser som brukes ved kateterskylling og kateterlås (7). Det er videre vist økt insidens av HIT hos kirurgiske versus medisinske pasienter (odds ratio (OR) 3,25; 95 % CI 1,98-5,35) (8). Terapeutiske doser av heparin gir større risiko for HIT enn profylaktiske doser med heparin (0,76 % vs. <0,1 %) (9). Kvinner har to ganger større risiko for HIT sammenlignet med menn (OR 2,37; 95 % CI 1,37-4,09), og høyeste risiko for HIT er sett hos kvinnelige kirurgiske pasienter som får ufraksjonert heparin (insidens fra 2,7 - 7,6 %; OR 17; 95 % CI 4,2-72) (8). Alder er også en disponerende faktor, og tilstanden forekommer svært sjeldent hos pasienter under 40 år, hos kvinner etter fødsel eller hos barn (10).
Symptomer og behandling
Trombocytopeni med trombocyttall <150 x109/L (referanseområde 150-450 x109/L) er det vanligste funnet ved HIT, og er vanligvis moderat med laveste trombocyttall rundt 60 x109/L. Det er svært uvanlig at trombocyttallet faller under 20 x109/L (11), og blødningssymptomer er sjeldne (12). Fall i verdier skjer typisk 5-10 dager etter oppstart av heparinbehandling, men det forekommer også en variant av HIT hvor fallet inntrer vesentlig raskere og innen 24 timer etter oppstart av heparin («rapid onset HIT»). Dette skyldes at pasienten allerede har sirkulerende HIT-forårsakende antistoffer etter heparinbruk siste tre måneder (13). Når HIT mistenkes skal heparin straks seponeres og alternativ antikoagulasjonsbehandling benyttes. Trombocyttallet vil da vanligvis normaliseres innen syv dager.
Tromboser vil kunne oppstå hos opp til 50 % av pasientene med HIT som ikke bytter til alternativ antikoagulant, og venøse tromboser er hyppigere enn arterielle (11). Komplikasjoner av trombosedannelse kan være livstruende lungeemboli, hudnekroser etc. (14,15,16). Akutte systemiske anafylaktiske reaksjoner som feber, frysninger, tachykardi, hypertensjon, dyspne og hjertestans er også beskrevet (17).
Utredning
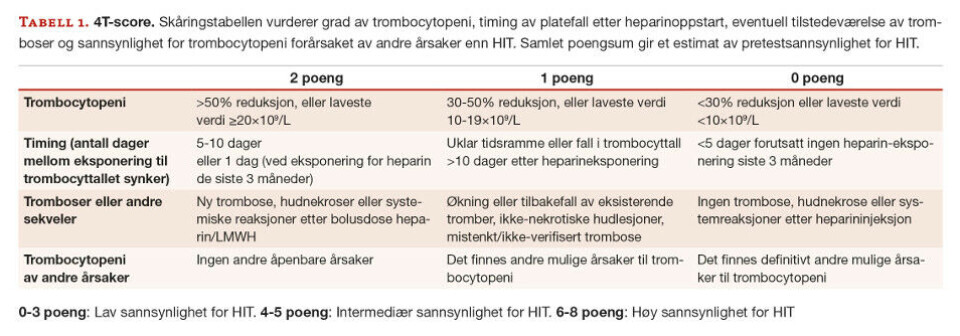
Som et viktig hjelpemiddel i utredningen av mistenkt HIT benyttes «4T-score» hvor kliniske funn oppsummeres og gir et estimat av pretest-sannsynlighet for HIT (tabell 1) (3). Poengsummen varierer fra 0-8 og ved klinisk sikker poengsum 0-3 vurderes sannsynligheten for HIT til å være svært lav med høy negativ prediktiv verdi (NPV) (99,8 %) (18). Utfordringen ved bruk at dette verktøyet er at det krever erfaring med skåringssystemet. I tillegg blir skåringen mer usikker dersom ikke alle nødvendige laboratorieprøver er tatt, eller hvis nødvendige kliniske journalopplysninger mangler.
Laboratoriediagnostikk
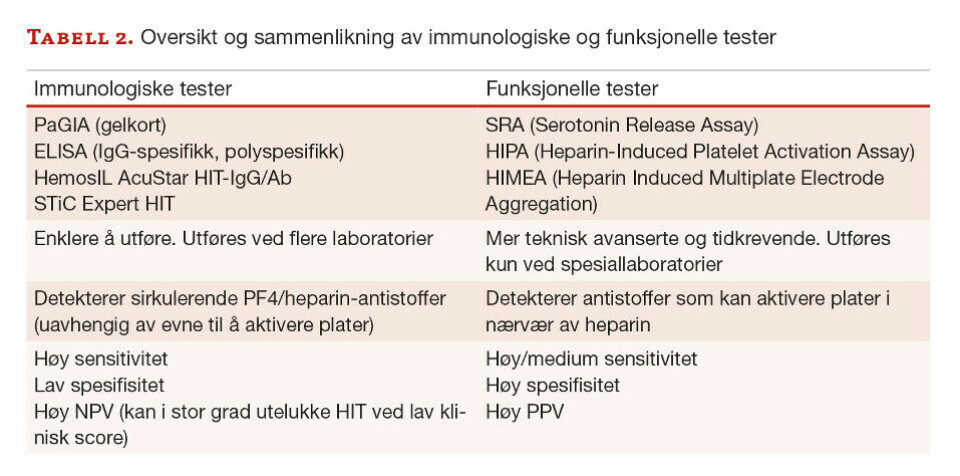
Diagnostikken av HIT er tredelt; klinisk vurdering (4T-score), immunologiske tester og funksjonelle tester. Klinisk vurdering er nødvendig for å estimere pretest-sannsynlighet for HIT, og må sammenholdes med resultatene av laboratorietestene. De immunologiske testene påviser tilstedeværelse av sirkulerende PF4/heparin antistoffer uavhengig av deres evne til å aktivere blodplater, mens de funksjonelle testene påviser disse antistoffenes funksjon, altså deres evne til å aktivere trombocytter i nærvær av heparin (klinisk signifikans). Slike funksjonelle tester er teknisk avanserte og tidkrevende, og utføres kun ved enkelte spesiallaboratorier. De immunologiske testene er ofte enklere å utføre, og mange laboratorier har hurtigtester i bruk. Generelt har de immunologiske testene høy sensitivitet, men med noe lavere spesifisitet og mange falske positive resultater. I likhet med klinisk sikker lav 4T-score vil negative immunologiske tester ha høy NPV og i stor grad kunne utelukke HIT, og det er dermed ikke hensiktsmessig å gå videre med funksjonelle tester. Til sammenligning har de funksjonelle testene lavere sensitivitet enn immunologiske tester, men til gjengjeld har de høy spesifisitet og positiv prediktiv verdi (PPV) som gjør at et positivt testresultat i stor grad bekrefter diagnosen HIT (19). I tabell 2 gis noen eksempler på ulike tester og en oppsummering av de viktigste forskjellene på immunologiske og funksjonelle tester. I Norge benyttes PaGIA elle STiC Expert ved enkelte laboratorier, mens Nasjonal behandlingstjeneste tilbyr PaGIA, ELISA og HIMEA.
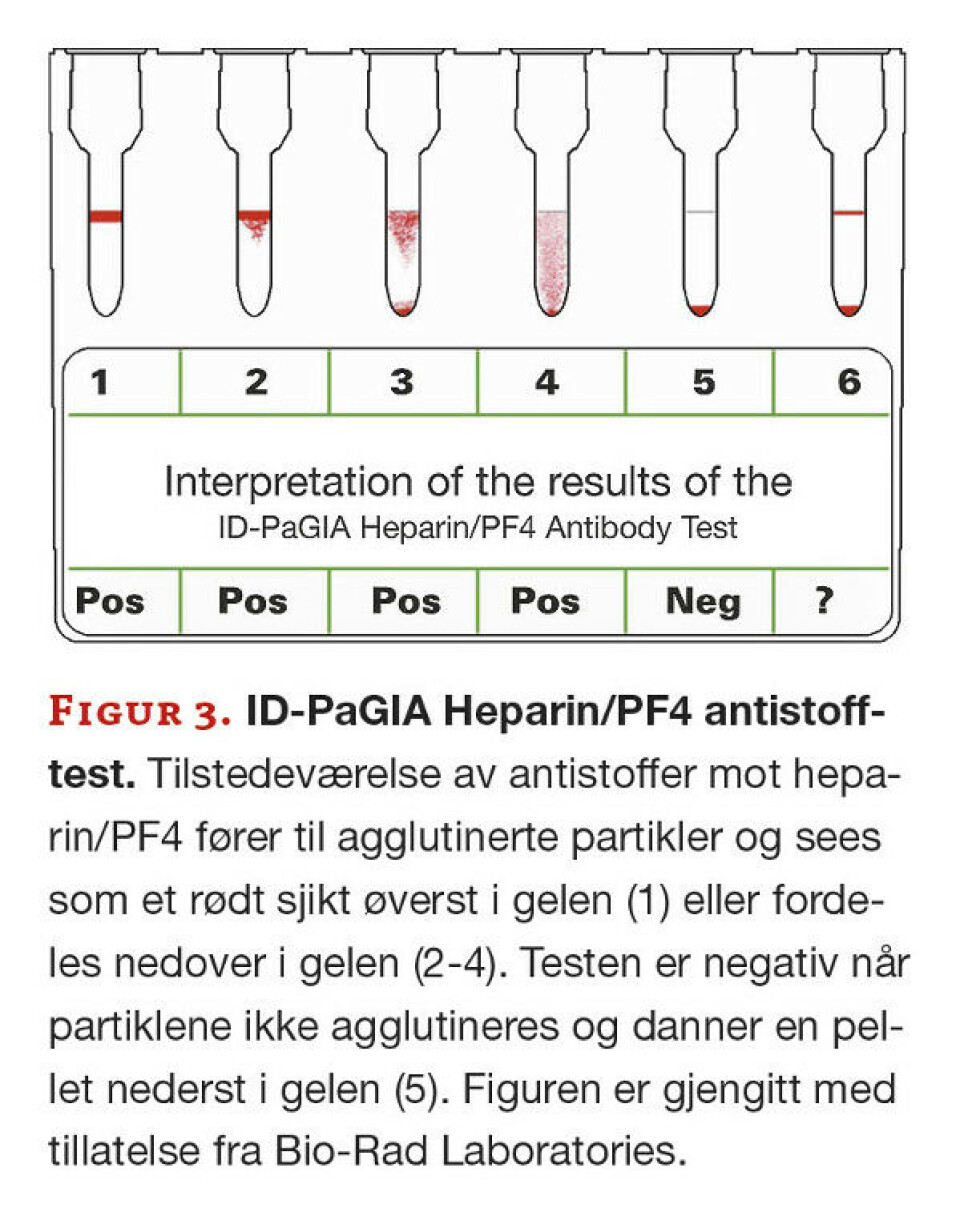
ID-PaGIA Heparin/PF4 antistofftest
Gelkorttesten er basert på røde partikler sensibilisert med PF4/heparin-komplekser i gelmatrix med kuler med anti-humant IgG. Pasientprøven (serum/plasma) inkuberes med partiklene i gelkortet, og ved eventuell tilstedeværelse av antistoffer mot kompleksene vil partiklene agglutineres. Ved sentrifugering vil ikke-agglutinerte partikler migrere gjennom kulematrix og samle seg på bunnen. Ved positiv reaksjon vil agglutinerte partikler danne et rødt sjikt på toppen av gelen eller fordeles noe nedover i gelen (figur 3). Denne hurtigtesten tar cirka 15 minutter å utføre, og krever visuell avlesning av resultatene (20). Testen tolkes med gradering av reaksjoner og skiller ikke mellom ulike antistoffklasser.
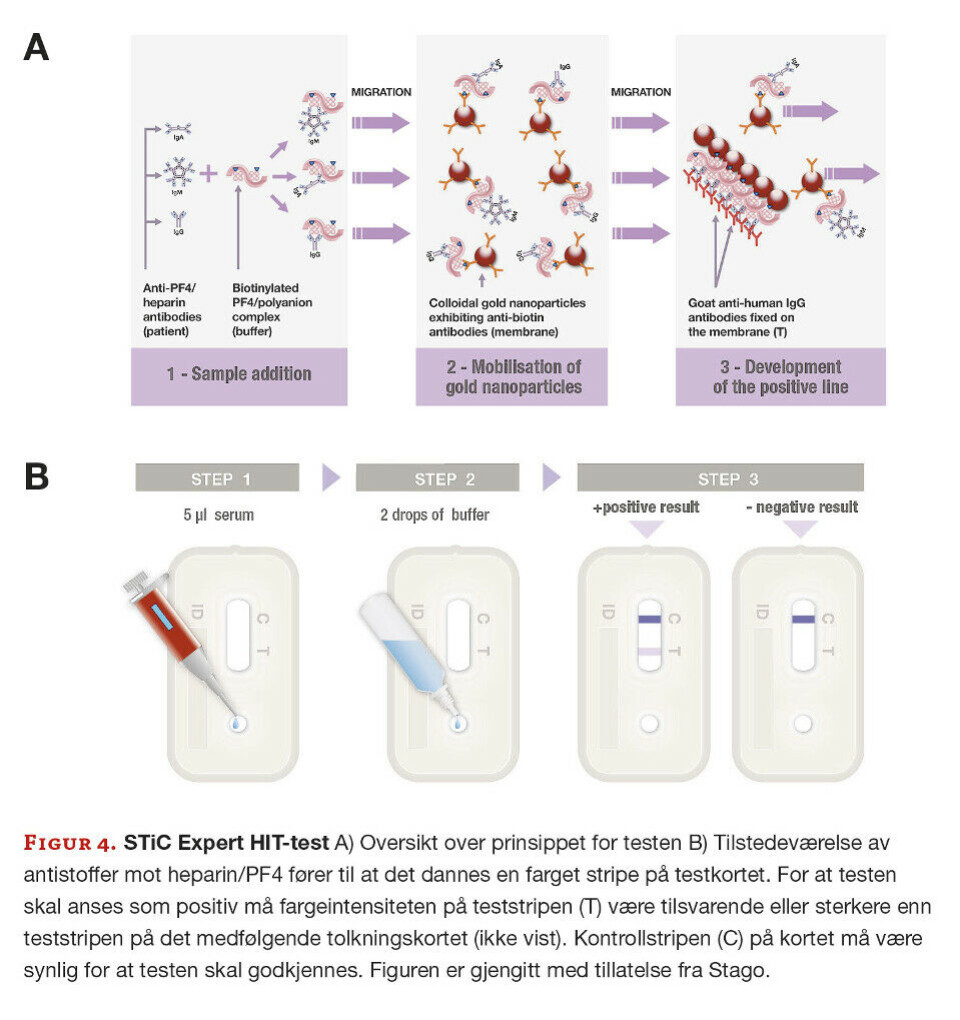
STiC Expert HIT
Denne testen baserer seg på lateral flow immunoassay-prinsippet. Pasientprøven (serum/plasma) og buffer med biotinylerte PF4/polyanion (analogt til heparin)-komplekser tilsettes testbrønnen. Ved migrering gjennom testkortet vil biotinylerte PF4/polyanionkomplekser binde anti-biotindekkede gullnanopartikler, og dersom pasienten har antistoffer mot kompleksene bindes disse til PF4/polyanion-kulekomplekset. Væskestrømmen vil vandre videre til området hvor teststripen er, og her binder kulekompleksene til geit anti-human IgG som er fiksert til membranen. Dette sees som synlig farget stripedannelse som tegn på positiv reaksjon (figur 4). Denne hurtigtesten tar cirka 10 minutter å utføre, og krever visuell avlesning av resultatene (21). Testen tolkes med en viss gradering av reaksjoner (svak/sterk positiv vs negativ) ved å sammenligne med teststripen på tolkningskortet (Evaluation card). Testen er positiv hvis resultatet er likt eller sterkere i fargen sammenlignet med teststripen på tolkningskortet. Kontrollstripen på kortet indikerer at testen har fungert tilstrekkelig ved å binde frie kulekomplekser som ikke er bundet av pasientens IgG-antistoffer. Testen er spesifikk for IgG-antistoffer.
ELISA Heparin/PF4 IgG assay
Testen baserer seg på en sandwich ELISA hvor pasientprøven tilsettes i en mikrotiterbrønn belagt med PF4/PVS(heparinanalog)-kompleks. Eventuelle kompleks-spesifikke antistoffer vil bindes og detekteres ved hjelp av enzymmerket sekundærantistoff (anti-human IgG) og påfølgende spalting av substrat og måling av fargeutvikling (OD) med spektrofotometri. OD-verdien korrelerer til mengde antistoffer mot PF4/heparinkomplekser som er bundet. Denne testen påviser kun IgG-antistoffer, og det er bare denne antistoffklassen som kan ha klinisk relevans ved sin plateaktiverende evne. Testen tar cirka to timer og avlesning av resultatet er digital og semikvantitativ (22). Med økende OD-verdier øker sannsynligheten for HIT (23).
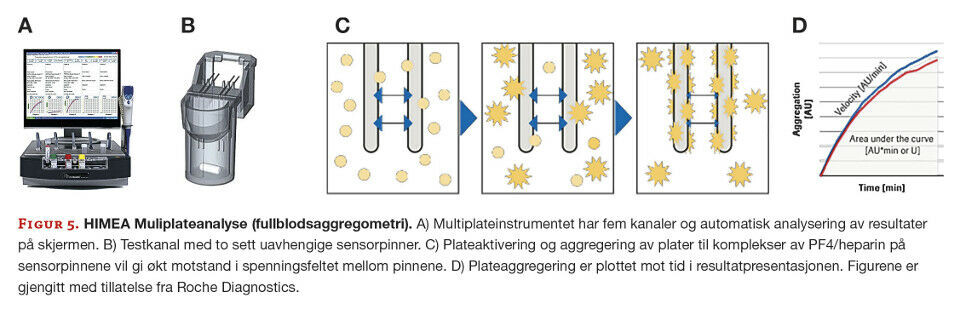
HIMEA (Heparin Induced Multiplate Electrode Aggregation) - fullblodsaggregometri
HIMEA-analysen benytter Mulitiplate® instrument med fem kanaler (figur 5A) hvor hver testkanal (figur 5B) inneholder to par sensorpinner for duplikattesting. Til hver testkanal tilsettes pasientserum, fullblod fra blodgiver (som blodplatekilde) og heparin i enten høy eller lav mengde. Videre vil en magnet skape et elektrisk spenningsfelt mellom hvert par av sensorpinner, som kontinuerlig måles. Disse pinnene er sølvdekte kobberpinner, og motstanden mellom pinnene øker etter hvert som blodplater fra blodplatedonor aktiveres og festes til pinnene hvis pasienten har antistoffer mot PF4/heparin-komplekser (figur 5C). Denne plateaggregeringen registreres som impedans på en kurve hvor «aggregation units» plottes mot tiden (figur 5D). Man får beregnet et areal under kurven (AUC) som benevnes med units (U) (24). Et positivt prøveresultat fremtrer med en typisk sigmoid form på kurven, en størrelse på AUC > 28 U og kun ved lav konsentrasjon av tilsatt heparin. Videre skal resultatet i kanalen med høy konsentrasjon av tilsatt heparin være minst 50 % lavere enn i kanalen med lav heparintilsetting (figur 6). Fordelene med HIMEA sammenlignet med andre funksjonelle tester er at analysetiden er betydelig kortere (15 minutter), man kan bruke fullblod i stedet for preparerte donorplater som platesubstrat, instrumenteringen er enkel med interaktiv pipette og analyseringen er automatisk og avlesbar på skjerm. I tillegg egner HIMEA seg godt for «singel-prøve testing». Sensitiviteten er rundt 80 % mens spesifisiteten er over 90 %. PPV er høy og nær 100 % (25).
Oppsummering
Det er viktig å tenke på HIT som en diagnostisk mulighet ved uforklarlig reduksjon i trombocyttall ved bruk av heparin i mer enn fire dager. Ved mistenkt HIT bør man seponere heparin, benytte alternativ antikoagulant og ta prøve til testing. Diagnostikken er tredelt med klinisk skåring, immunologiske tester og funksjonelle tester. De immunologiske testene har høy sensitivitet, men påviser også antistoffer som ikke aktiverer plater og som dermed ikke er klinisk relevante (lavere spesifisitet). De immunologiske testene har høy NPV slik at negativ test vil kunne utelukke HIT, og især hvis klinisk skåring er lav. Funksjonelle tester bedrer spesifisiteten i stor grad, og PPV er høy. Positive funksjonelle tester vil i så måte bekrefte HIT-diagnosen.
Nasjonal behandlingstjeneste for avansert trombocyttimmunologi ved UNN utfører alle laboratorieanalyser som er nødvendige for å stille en HIT-diagnose, inkludert funksjonelle tester. Vi kan tilby en fullverdig HIT-utredning på alle tre nivåer, tilsvarende det som tilbys internasjonalt. Vi viser til vår nettside og rekvisisjon med opplysninger om korrekt prøvetakning, forsendelse og nødvendige kliniske opplysninger (4T-score og tidspunkt for seponering av heparin) (26).
Les også artikkelen "HIT happens" - det fikk Eva Lisa Piiksi erfare
























