FAG resymé
Identifisering og subklassifisering av pasienter med hjerneslag
Av HENRIETTE SOLBERG JÆGER, bioingeniør med mastergrad i bioteknologi. Stipendiat i Stiftelsen Norsk Luftambulanse.
E-post: henriette.solberg@norskluftambulanse.no
Identifisering og subklassifisering av hjerneslag allerede i ambulansen gjør det mulig å transportere pasienter direkte til riktig behandlingssted. Ved direkte transport til riktig behandlingsted reduseres tiden fra symptomene oppstår til diagnosespesifikk behandling kan startes. Vi har undersøkt om kombinasjonen av en biomarkør og en slagskala kan bidra til dette.
Hjerneslag
På verdensbasis er hjerneslag en av hovedårsakene til funksjonsnedsettelse og død. Hjerneslag forårsakes av blodpropp (AIS) eller blødning, og de to årsakene kan ikke skilles fra hverandre klinisk fordi symptomene er de samme. I dag kreves bildediagnostikk med CT eller MR før man kan sette i gang riktig behandling, og behandlingseffekten er sterkt tidsavhengig.
Behandling med trombolyse og/eller trombektomi (blodproppfisking) har bedret utfallet for pasienter med AIS. Mistenkte hjerneslagpasienter transporteres til nærmeste sykehus for bildediagnostikk og klinisk undersøkelse før diagnosespesifikk behandling kan settes i gang.
Trombolysebehandling må startes innen 4,5 timer etter symptomdebut, mens trombektomi, som utføres på intervensjonssenter, bør utføres innen 6 timer etter symptomdebut på pasienter med storkarokklusjoner (LVO), en undergruppe av AIS. Etter bildediagnostikk på nærmeste sykehus transporteres LVO-pasienter videre til trombektomi.
Om en pasient med LVO transporteres direkte til intervensjonssenter, har vedkommende redusert tid fra symptomdebut til trombektomi. Transport mellom sykehus er assosiert med forlenget tid fra symptomdebut til trombektomi, og dårligere utfall for pasientene. Om pasienter med blødning transporteres direkte til intervensjonssenter, kan behandlingen bli forsinket. Derfor kreves bedre diagnostiske verktøy for å differensiere subtyper av hjerneslag utenfor sykehus.
Glial Fibrillary Acidic Protein (GFAP) er et protein som frigjøres etter vevsskade i hjernen. Nivået av GFAP er signifikant høyere i pasienter med blødning, sammenlignet med pasienter med AIS og hjerneslagsimitatorer (SM).
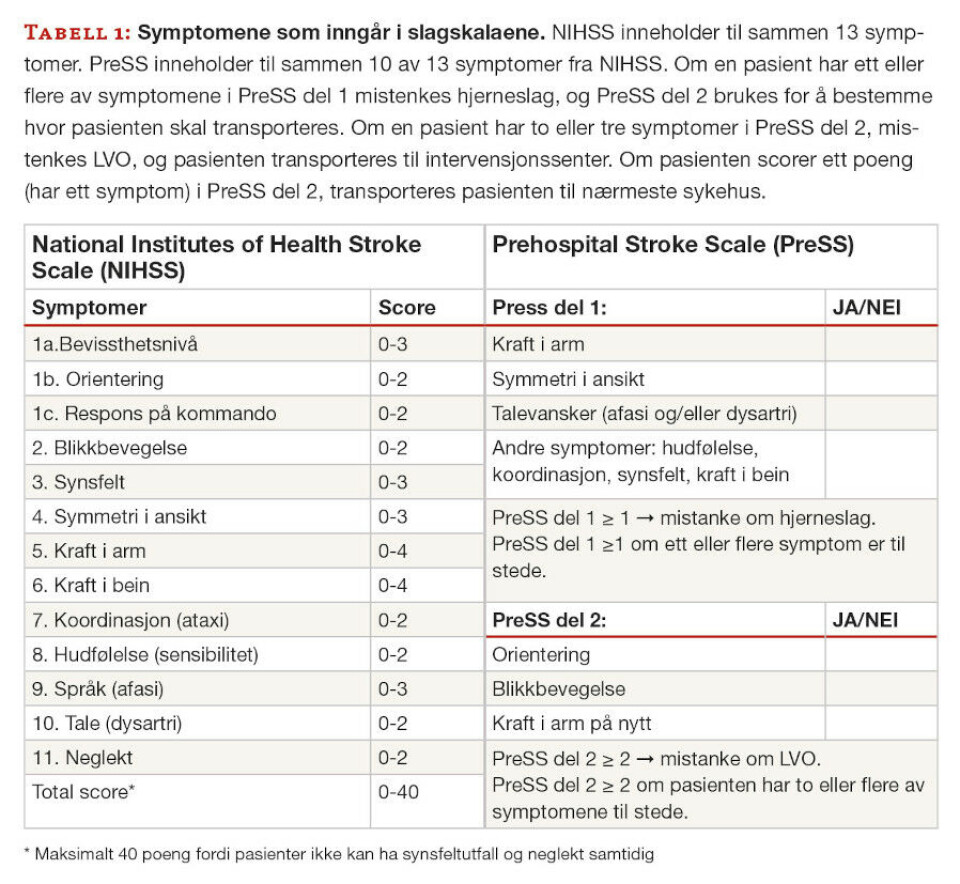
National Institutes of Health Stroke Scale (NIHSS) er slagskalaen som brukes inne på sykehus. Prehospital Stroke Scale (PreSS) er en to-delt slagskala som til sammen inneholder de fleste av symptomene som NIHSS, men PreSS er organisert annerledes og dikotomisert (tabell 1). PreSS del 1 har til hensikt å skille pasienter med mistanke om hjerneslag fra andre pasienter. PreSS del 2 har til hensikt å identifisere pasienter med LVO, og på den måten identifisere pasienter som kan ha nytte av direkte transport til intervensjonssenter.
Hensikten med studien var å teste hvor godt GFAP, en biomarkør for blødning, og PreSS kunne identifisere og subklassifisere hjerneslag i en uselektert populasjon av pasienter med symptomer på hjerneslag.
Om studien
Slagambulansestudien ble gjennomført i Østfold fra 15. mai 2017 til 27. mars 2020. Pasienter over 18 år med pågående hjerneslagsymptomer, møtt av slagambulansen eller vanlig ambulanse innen fire timer etter symptomdebut, ble inkludert. Ved inklusjon til studien ble NIHSS vurdert og blodprøver tatt. Blodprøvene ble tatt av paramedic i ambulanse eller av bioingeniør ved ankomst sykehus. I denne studien ble alle pasienter med blodprøve og NIHSS-verdi fra samme tidspunkt inkludert.
NIHSS ble retrospektivt oversatt til PreSS. En alikvot med 0,5 mL serum ble sendt til Quanterix i USA for analysering av GFAP på en HD-1 analyzer.
Endediagnose ble hentet ut fra journal. AIS-pasienter hadde infarkt på bildediagnostikk, og/eller symptomer etter 24 timer. Pasienter med TIA (også kalt drypp) hadde regress av symptomer innen 24 timer, ingen infarkt på bildediagnostikk og fikk ikke trombolyse. På grunn av absolutt kontraindikasjon for trombolyse ble alle pasienter med blødning i hodet (ICrH) samlet i en gruppe. Pasienter som ble skrevet ut med andre diagnoser (ikke relatert til hjerneslag) ble samlet i en gruppe med hjerneslagsimitatorer (SM).
Kombinasjonen av GFAP og PreSS
NIHSS og serum fra totalt 299 mistenkte hjerneslagpasienter ble analysert. Pasientpopulasjonen inkluderte AIS (n = 131, hvorav 27 hadde LVO), ICrH (n=32), TIA (n=22) and SM (n=114). Median tid fra symptomdebut til blodprøvetaking var 77 minutter.
PreSS del 1 identifiserte hjerneslag (forårsaket av både blødning og AIS) og TIA med en sensitivitet på 94% og en spesifisitet på 17%. PreSS del 2 identifiserte LVO med en sensitivitet på 56% og en spesifisitet på 77%.
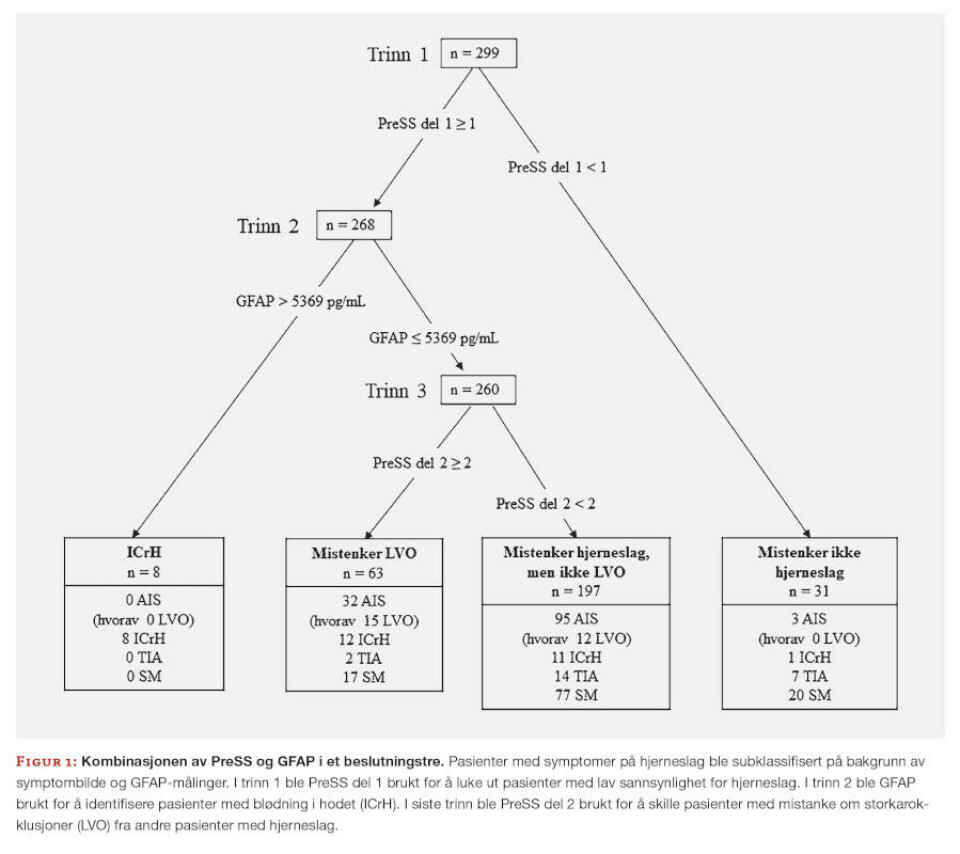
En cut-off-verdi på 5369 pg/mL isolerte en gruppe med ICrH med 100% spesifisitet, og ble brukt videre i kombinasjon med PreSS i et beslutningstre (Figur 1). I trinn 1 ble pasienter som ikke hadde noen av symptomene i PreSS del 1 ekskludert fra videre gruppering. I trinn 2 ble en gruppe med ICrH isolert med GFAP > 5369 pg/mL. I trinn 3 ble PreSS del 2 brukt for å skille pasienter med høy og lav sannsynlighet for LVO. I kombinasjon med GFAP økte spesifisiteten til PreSS del 2 til 82% i å detektere LVO.
Oppsummering
Denne studien viser at kombinasjonen av en biomarkør og en slagskala sammen indentifiserer og subklassifiserer hjerneslagpasienter bedre enn slagskalaen og biomarkøren hver for seg. Beslutningsverktøy basert på biomarkører og symptomer har stort potensiale i fremtidens diagnostikk av akutt hjerneslag.
Referanse
- Jæger HS, Tranberg D, Larsen K, Valentin JB, Blauenfeldt RA, Luger S, et al. Diagnostic performance of Glial Fibrillary Acidic Protein and Prehospital Stroke Scale for identification of stroke and stroke subtypes in an unselected patient cohort with symptom onset < 4.5 h. Scand J Trauma Resusc Emerg Med. 2023;31(1):1-11.
























