Fag i praksis

Implementering av automatisert, kvantitativ måling av blod i feces med immunologisk metode
Medisinsk biokjemi Ålesund (LMBÅ) ønska ein meir sensitiv og spesifikk metode for testing av blod i feces. Dette ville kunne bidra til at alvorlege sjukdommar oppdagast tidlegare, og at koloskopi vart gjort grunna meir sikre indikasjonar.
Av ASTRID LIED, fagbioingeniør, Medisinsk biokjemi, Ålesund sjukehus, Helse Møre og Romsdal
Friske personar taper 1-2 mL blod per døgn via tarmkanalen. Meir enn 2-3 mL blod per døgn, eller cirka 2 mL blod per 100 g feces reknast som patologisk (1). Auka mengd blod i feces kan ha mange årsaker, heilt frå ufarlege tilstandar til kreft. Eksempel er hemoroidar, bruk av marevan, inflammatorisk tarmsjukdom (IBD), polyppar og kolorektal kreft (tarmkreft), som er av dei vanlegaste kreftformene i Norge.
Undersøking av blod i feces er aktuelt for å avdekke skjulte blødingar (okkult blod) i nedre del av gastro-intestinaltraktus. Dette kan vere når det er kliniske indikasjonar hos ein pasient, som til dømes fallande hemoglobin/ jernlager av ukjent årsak. Ein studie frå 1996 synte at ein ikkje fekk positivt utslag på testen dersom ein blødde <100 mLper døgn i øvre/midtre tarmsystem. Grunnen til dette er at globin blir nedbrote av proteasar i mage og tarm (2).
Tjukktarmkreft var i 2019 den fjerde vanlegaste kreftforma i Norge (2979 nye tilfelle). Tjukktarm og endetarmskreft stod i 2019 på andreplass over dødsfall (1496) etter kreftform (3). Det kan ta mange år frå dei første unormale cellene oppstår til dei degenererer til kreftceller. Også desse forstadia vil gjerne blø. Ved å avdekke dette tidleg kan ein fjerne cellene før dei utviklar seg til kreft. Tidleg diagnose er dermed avgjerande for behandling og prognose.
På laboratoriet har vi brukt ein tradisjonell guajak-basert kjemisk metode (Hemofec, gFOB) for påvising av okkult blod i feces. Denne er enkel i bruk, og gir raskt eit svar. Det er imidlertid kjent at metoden har fleire ulemper. Den er ikkje særleg sensitiv, og gir positivt utslag i 10-35 % av tilfella med cirka 2 mL blod per 100 g feces og i 80-90 % av tilfella med cirka 5 mL blod per 100 g feces (1). Metoden interfererer med mellom anna peroxidase, som finns i ei rekkje vanlege matvarer. Dette fører til strenge kostrestriksjonar før prøvetaking. Vidare må det takast prøver over tre dagar. Alt dette gjer at prøvetakinga er krevjande for pasientane, og dårleg etterleving av kostrestriksjonane fører ofte til upålitelege resultat. I tillegg fører visuell avlesing av resultatet til stor variasjon, noko som styrkar ønsket om ein automatisert metode.
Bruk av immunologiske metodar for blod i feces (iFOB) har mange fordelar:
- Er standard metode i dag, og brukast i nasjonale screening-program i fleire land
- Ingen kostrestriksjonar, då ein nyttar antistoff mot humant hemoglobin
- Betre aksept hos pasientar, som slepp kostrestriksjonar og berre må ta ei prøve
- Meir spesifikk enn gFOB-metoden
- Meir selektiv for kolorektal bløding
- Auka deteksjonsrate for kreft og forstadium til kreft enn gFOB
Ved LMB Ålesund har vi cobas 8000 frå Roche, og produsenten tilbyr ingen metode for blod i feces. Det vart difor vald ein metode frå ein tredjeparts-leverandør, som vart sett opp på eksisterande instrument ved bruk av open kanal.
Ved verifisering av «vanlege» klinisk-kjemiske metodar utfører ein gjerne samanlikning med eksisterande metode, eventuelt med eit anna laboratorium. Eigna materiale er oftast enkelt å finne blant analyserte prøver på laboratoriet. Dette ville ikkje vere mogleg i dette tilfellet.
Utover vanlig testing som presisjon og riktigheit, måtte vi også fastsette cut-off for analysen.
Det dukka også opp mange praktiske problemstillingar:
- På cobas 8000 var feces eit nytt prøve-materiale. Ville prøvene kunne skade instrumentet, eller ville det forureine pipettar/kuvettar og slik påverke andre analysar?
- Forma på prøverøra/korka var annleis enn blodprøvene. Dessutan valde vi å handtere alle prøvene som om dei er forureina utanpå, sjølv om dei fleste såg reine ut. Det var difor ikkje aktuelt å bruke preanalyseeininga, cobas 8100, til prøvene.
- Ville prøvene kunne settast rett på instrumentet utan alikvotering på førehand? Det var viktig med minst mogleg handtering av prøvene, både av hygieniske årsaker og for effektiviteten sin del.
- Korleis sikre rett prøvetaking? Det ville vere viktig med eit godt informasjons-skriv om dette.
Metode
Fleire metodar kunne vere aktuelle, men tidleg i prosessen vart metoden «Quantitative immunoturbidimetric latex determination of human haemoglobin in faeces» frå Sentinel Diagnostics (4) peika ut som mest aktuell for oss. Det var laga applikasjonar med metoden for ei rekke instrument, blant anna til Roche cobas 8000 c702 (5). Til metoden var det også tilhøyrande kalibratorar sporbare til IRM-467/IFCC, samt kvalitetskontrollar i to ulike nivå og diluent til fortynning av høge prøver.
Metoden kravde bruk av eigne prøverør, FOB Gold® Tube Screen. Røra inneheld 1,7 mL ekstraksjonsløysing. Den fargelause korka skal ikkje opnast ved prøvetaking. Grøn kork er festa til ein prøve-pinne med riller nedst. Når pinnen settast på plass i røret att, vil den gå gjennom eit hol som til ein viss grad standardiserer prøvemengda. Likevel er det viktig å ta rett mengd feces (figur 1), og ikkje opne feil kork.
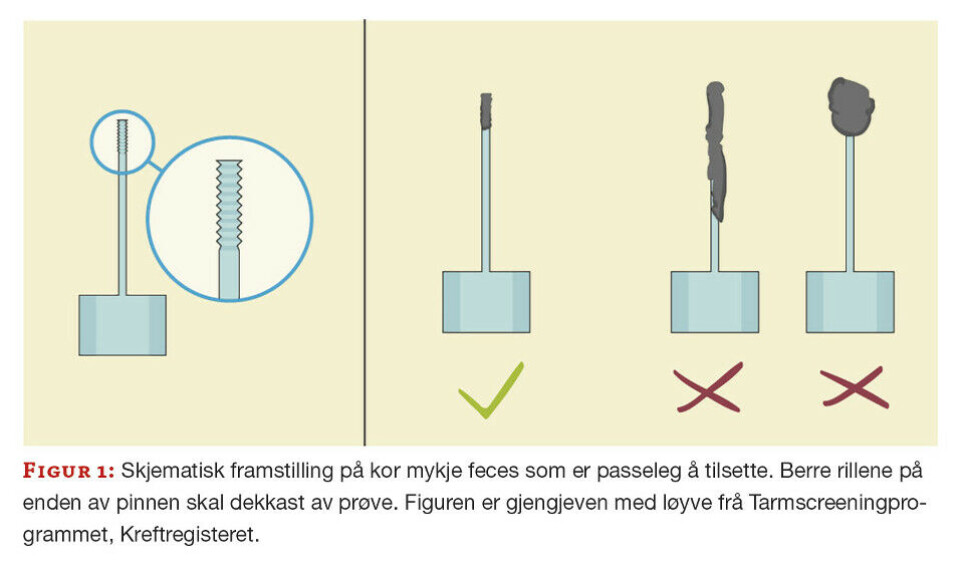
Metoden er kvantitativ, og resultata vert utgitt i µg Hb/g feces. Reaksjonen er basert på ein antigen-antistoff agglutinasjon-reaksjon mellom humant hemoglobin i prøva og polyklonalt anti-humant hemoglobin-antistoff på polystyrenpartiklar.
Agglutinasjonen gir auka absorpsjon ved 570 nm, og er proporsjonal med innhaldet av humant hemoglobin i prøva. Metoden er spesifikk for humant blod, og krev ingen kostrestriksjonar.
For å sikre mot carry-over vart det lagt inn ekstra vask både av prøvepipettar og kuvettar.
Det viste seg at prøverøra passa i prøve-rack utan innsats. Pinnen brukt til prøvetakinga stikk opp i bufferen/ prøva, men det er så god avstand mellom denne og væskeoverflata at prøvene kunne settast rett på instrumentet etter sentrifugering.
Verifiseringsplan
Presisjon
Repeterbarheit (i serie) finnast ved å analysere pasientprøve på cirka 10 µg Hb/g feces (planlagt cut-off) i serie med 10 replikat.
Krav: CV bør vere innanfor leverandøren sine spesifikasjonar (CV = 4,0% ved 16,3 µg Hb/g feces)
Reproduserbarheit (frå dag til dag) finnast ved å analysere kontroll-materiale i to nivå i 20 dagar. Krav: CV bør vere < 10 % (6).
Riktigheit
Gullstandard for å avdekke bløding i nedre del av tarmsystemet (tjukktarm og endetarm) er koloskopi. I samarbeid med gastroenterologisk avdeling ved Ålesund sjukehus blei 50 pasientar som skulle til koloskopi bedne om å ta prøve til iFOB. Denne skulle takast rett før undersøkinga.
Resultata ville bli klinisk vurdert. Det vart ikkje satt eit kvantitativt krav til riktigheit, kun ei kvalitativ vurdering.
Bias blei vurdert som differansen mellom våre gjennomsnitt-resultat på kontrollane og leverandørens target-verdi. Kontrollprøver i to nivå skulle analyserast minst 20 gongar. Kravet vart sett til B < 8,5% (basert i utgangspunkt på tillatt totalfeil i EQA-program).
I tillegg er det tatt med eksterne kvalitetskontrollar frå Labquality sitt program «Faecal occult blood». Desse analyserast i duplikat for vurdering av riktigheit. Det vart satt same krav som for bias.
Verifisering av cut-off verdi
Ein ofte nytta cut-off er 10 µg Hb/g feces (7), og vi planla å bruke denne viss funn frå våre undersøkingar samsvara med dette. Om denne verdien er eigna som cut-off vurderast ved å samanlikne resultata frå iFOB med funn frå koloskopi.
Det er ein hårfin balanse ved val av cut-off. Som figur 2 syner er det ei tydeleg overlapping mellom Hb-konsentrasjonen hos normale pasientar og pasientar med tarmkreft. Ved å sette cut-off lavt vil ein kunne få mange falskt positive resultat, og dermed unødige koloskopiar (A). Ved optimal cut-off vil andelen av falskt positive og falskt negative resultat vere lave (B). Ved å sette cut-off høgt vil ein få mange falskt negative resultat som fører til at pasientar med alvorlege diagnosar ikkje blir sendt til koloskopi (C). Det er viktig å ikkje sette verdien for høgt, og slik risikere at alvorlege tilstandar ikkje blir fanga opp.
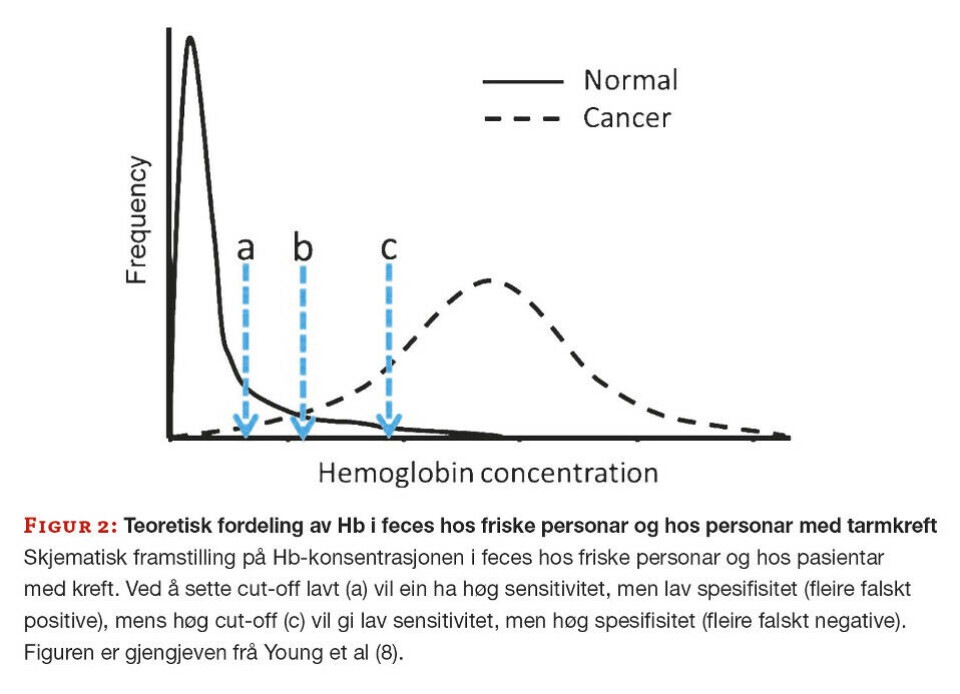
Ved vurdering av eit resultat er det uansett viktig å sjå på den totale klinikken hos pasienten, slik at resultat under cut-off ikkje hindrar at ein pasient vert følgt opp vidare.
Resultat av verifiseringa
Presisjon
Verifisering av repeterbarheit (presisjon i serie) baserer seg på analysering av 10 replikat av ei pasientprøve i ein serie. Resultatet viser ein variasjonskoeffisient på CV = 3,9% (ved 10 µg Hb/g feces) og oppfyller kravet vårt.
Reproduserbarheita (presisjon frå dag til dag) vart verifisert ved bruk av både kontroll- og pasient-prøve. Kontrollprøver i to konsentrasjonsnivå blei analysert i 26 dagar. Resultata viste CV = 6,1% (ved 16,8 ug/g feces) og CV = 8,6% (ved 58 µg Hb/g feces) og oppfylte kravet vårt på <10%.
Presisjonen i reell prøvematriks vart i tillegg verifisert med pasientmateriale. Dette var ikkje i planen, men vart gjort likevel. For å sikre god nok haldbarheit i ei pasientprøve, vart den fordelt i 10 alikvotar og fryst ved -70oC. Desse blei analyserte i 10 påfølgjande dagar. Variasjonskoeffisienten på CV = 2,8% oppfyller det same kravet på < 10%.
Riktigheit
Metodens riktigheit blei vurdert som bias i forhold til oppgitt target av interne og eksterne kontrollprøver, og ved samanlikning med gullstandarden som er gjennomføring av koloskopi på pasienten.
Interne kontrollar i to nivå vart analyserte i 26 dagar. Bias blei vurdert i forhold til targetverdi oppgitt frå produsent. Resultata synte ein bias på -3,8% (ved 16,8 µg Hb/g feces) og +1,9% (ved 58 µg Hb/g feces) i forhold til targetverdiane. Metoden oppfylte kravet vårt til maksimal bias på ± 8,5%.
Det blei også analysert to eksterne kontrollprøver i duplikat. Begge prøvene vart vurderte som positive. Resultata våre stemte med fasiten. Fasit i kontrollprøvene var fastsett kvalitativt av EQA-leverandør. Ein kvantitativ vurdering var difor ikkje mogleg.
Pasientprøver samanlikna med koloskopi
Målet var å få 50 prøver. Dette skulle vise seg å bli vanskeleg innanfor ei akseptabel tidsperiode. Mange var ikkje villige til å ta dette ekstra-arbeidet når dei uansett skulle til koloskopi. Vi enda difor opp med 30 prøver til innkøyringa.
Tabell 1 viser resultat av analyseringa, samanlikna med funn sett ved koloskopi. Ved bruk av cut-off på 10 ug/g feces vart 10 prøver klassifiserte som «positiv» og 20 prøver som «negativ».

To positive prøver synte normale resultat ved koloskopi. Den eine av desse viste 13 ug Hb/g feces, og var dermed minimalt over cut-off verdien på 10 ug Hb/g. Den andre var betydeleg høgare enn cut-off. Årsaka til dette er ukjent, men nokre slike funn er venta (figur 2). Alle andre pasientane med positiv iFOB viste positive funn under koloskopi (kreft, IBD, polypp).
Alle negative resultat vart bekrefta med koloskopi. Hos fem av desse vart det påvist små polyppar som enno ikkje viste teikn til bløding.
Resultata blei fagleg vurdert i samarbeid med gastroenterologisk avdeling. Basert på det avgrensa talet prøver vart testens riktigheit vurdert som bra.
Konklusjon av verifiseringa
Metoden oppfylte våre krav til presisjon og riktigheit/bias. Samanlikning med gullstandard koloskopi synte ingen falskt negative resultat, og få falskt positive. Cut-off verdien på 10 ug Hb/g feces var i tråd med internasjonal litteratur og blei vurdert som passeleg i startfasen (8).
Det vart bestemt at dersom det etter ei tid viste seg at cut-off var for lav og førte til for mange unødige koloskopiar, måtte endring av verdien vurderast.
Implementering og vegen vidare
Det vart sendt ut informasjon til rekvirentane, som også inneheldt informasjon om indikasjon for testen. Det vart også laga ei prosedyre for prøvetaking som leverast ut saman med prøverøra.
Metoden vart tatt i bruk frå 7. oktober 2019. I starten vart den breidda til Ålesund sjukehus sitt område. Analysen vart utført i batch to gongar i veka. Etter ei tid vart dette utvida til heile Møre og Romsdal, og vi auka til analysering tre gongar i veka.
Tilbodet har blitt godt mottatt, og vi ser eit stadig aukande analysetal. Metoden opplevast som stabil og sikker. Vi har også fått gode tilbakemeldingar frå gastroavdelinga.
Dei største utfordringane er det preanalytiske. Vi har difor hatt revisjonar på prøvetakingsprosedyren, og vi har også bedt rekvirentane om å sikre seg at pasientane har forstått denne før dei får med seg rør heim. Likevel opplever vi stadig ulike variantar av dårleg eller direkte feil prøvetaking, og det er ikkje alltid lett å vurdere om vi skal avvise ei prøve (figur 3).
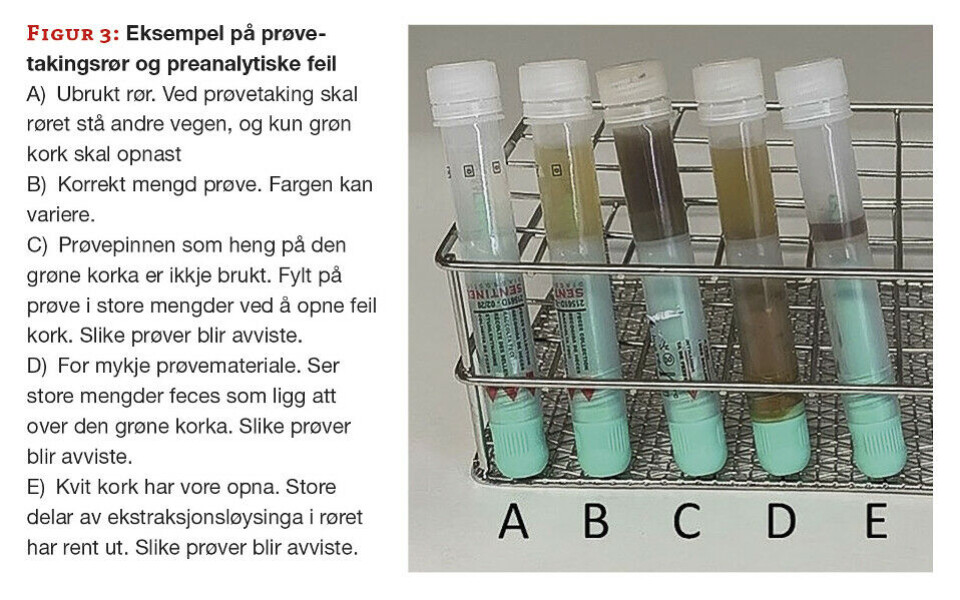
Både konsistens og farge på feces varierer mykje, og det gjer at det ikkje er nokon fast regel for kva farge eller kor sterk farge prøvene har. Det vi er mest redde for med tanke på feil ved prøvetaking er at nokon etterfyller røret med vatn når dei ser at væska i røret renn ut. Den er fargelaus, og for pasientane kan det vere lett å tru at det berre er vatn. Å erstatte væska med vatn vil kunne få store følger for prøveresultatet, og vil vere nær umogleg å oppdage. Nokre prøver er tydeleg opna i feil ende, og feces er tilsett utan å bruke prøvepinnen. Andre gongar er vi usikre på om det i det heile er tilsett prøvemateriale.
Vi står også ofte i eit etisk dilemma der vi må ta omsyn til kvaliteten på resultatet vi gir ut, og menneskelege omsyn. Pasientane er ofte ikkje vande til å ta prøver og lese instruksjon. Særleg for sjuke og eldre er dette ei utfordring. Det er også mange framandspråklege og andre som ikkje les godt norsk. Vi tenkjer difor å omsette prøvetakingsprosedyren til fleire språk, i første omgang til engelsk. Vi håper også at god forklaring til rekvirentane om årsak til avviste prøver på sikt vil hjelpe.
Etter å ha nytta metoden i over eit år ser vi at metoden er stabil og god, og vi ser heller ikkje nokon grunn til å endre cut-off.
Takk
Takk til laboratoriespesialist Lutz Schwettmann ved Ålesund sjukehus og seksjonsleiar Marie Nora Roald for innspel til artikkelen.
Les også artiklene "Tarmkreftscreeningen rulles ut i år" og "HemoFec eller iFOBT i primærhelsetjenesten?"























