FAG i praksis
Implementering av nye analysar - korleis gjer vi det?
Ved implementering av nye analysar er kvalitetssikringsarbeid viktig. Denne artikkelen viser verifiseringsprosessen ved implementering av ein ny analyse; anti-HMGCR. Analysen er sjeldan positiv, noko som gjer at verifiseringsprosessen er utfordrande og tidkrevjande.
Av NOEMIE ROSE M. TAER, spesialbioingeniør, Avdeling for immunologi og transfusjonsmedisin, Seksjon for medisinsk immunologi, Oslo universitetssykehus Ullevål
Implementering av nye analysar - korleis gjer vi det.pdf(176 KB)
Seksjon for medisinsk immunologi (MI) utfører autoantistoffpåvisning, allergologiske testar med eit utvida panel av allergenkomponentanalysar - og ulike proteinanalysar relatert til inflammasjon. Seksjonen sørgjer samtidig for eit oppdatert analyserepertoar ved å innføre nye analysar etter førespurnad frå rekvirentar.
Ved innføring av ein ny analyse på laboratoriet, må analysen kvalitetssikrast gjennom anten full metodevalidering eller verifisering. Dette er ein viktig del av kvalitetssikringsarbeidet i seksjonen. Implementering av nye analysar er ein krevjande prosess. Vi er eit spesielt laboratorium som tilbyr og utfører analysar som ingen andre laboratorium i landet gjer, og prøvegrunnlaget er ofte lite. Det er ei utfordring for oss å samle nok prøvemateriale og å definere kva som er «godt nok».
I 2017 valte vi å implementere ein ny analyse av autoantistoffet anti-HMGCR (anti-3-hydroksy-3-metylglutaryl-koenzym A-reduktase) ved bruk av enzyme-linked immunosorbent assay (ELISA) metodikk (QUANTA Lite ®HMGCR, Inova Diagnostics). Bakgrunn for innføring av anti-HMGCR i vårt analyserepertoar er at fleire rekvirentar ynskjer analysen til pasientane sine. Vi har tidlegare sendt prøvane til Statens Serum Institutt (SSI) i København. Etter vurdering av det store kostnadsbiletet er det hensiktsmessig og mindre kostbart for laboratoriet å utføre analysen sjølv ein gang i månaden. Klinisk nytteverdi er vurdert av medisinskfagleg ansvarleg på seksjonen. Vi har ikkje utført risikovurdering på denne analysen sidan ELISA-metoden som vi skal bruke er ein kjent og etablert metode som vi brukar dagleg i rutinen vår.
Analysen er validert hjå SSI og leverandøren (Inova Diagnostics), og då er det tilstrekkeleg for oss å verifisere om metoden fungerer med same kvalitet i laboratoriet vårt.
Denne artikkelen viser verifiseringsprosessen, og til slutt implementering av analysen i rutinen vår.
Verifisering av anti-HMGCR
Verifiseringsprosessen innebar to fasar; plan og rapport (sjå figur 1).
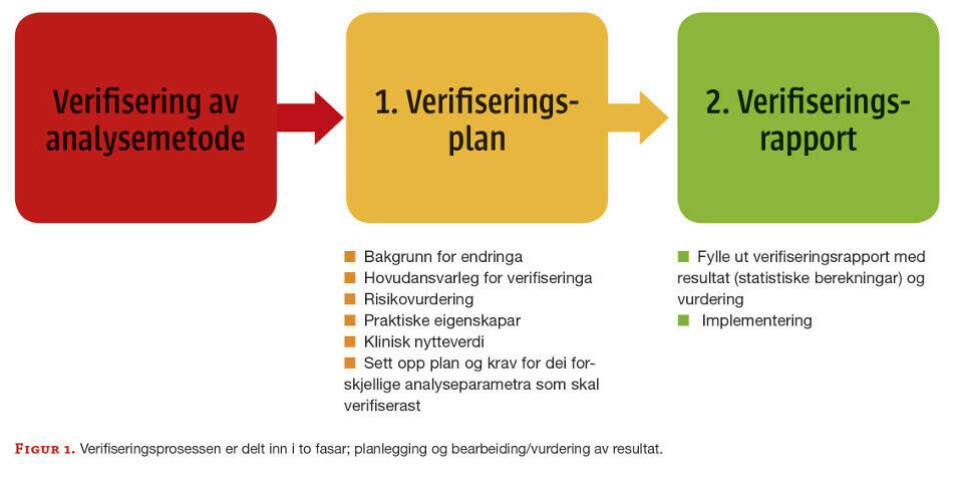
Verifiseringsplan
Det fyrste ein gjer er å lage ein plan for prosessen. Verifiseringsplanen blir utfylt av verifiseringsansvarleg i samarbeid med seksjonsleiar, medisinsk ansvarleg og fagbioingeniør for kvalitet. Ved ELISA-metodikk skal følgjande parametrar verifiserast: presisjon med repeterbarheit og reproduserbarheit, riktigheit og linearitet. Det blir laga ei beskriving på korleis verifiseringa av dei forskjellige analyseparametrane skal utførast (sjå punkt nedanfor). I følgje ISO 9001:2015 er det organisasjonen sjølv som skal bestemme kvalitetsmåla slik at dei er konsistente med tanke på å oppnå samsvar med leverte produkt og tenestar, og til forbetring av kundetilfredsheita (1) .
Presisjon
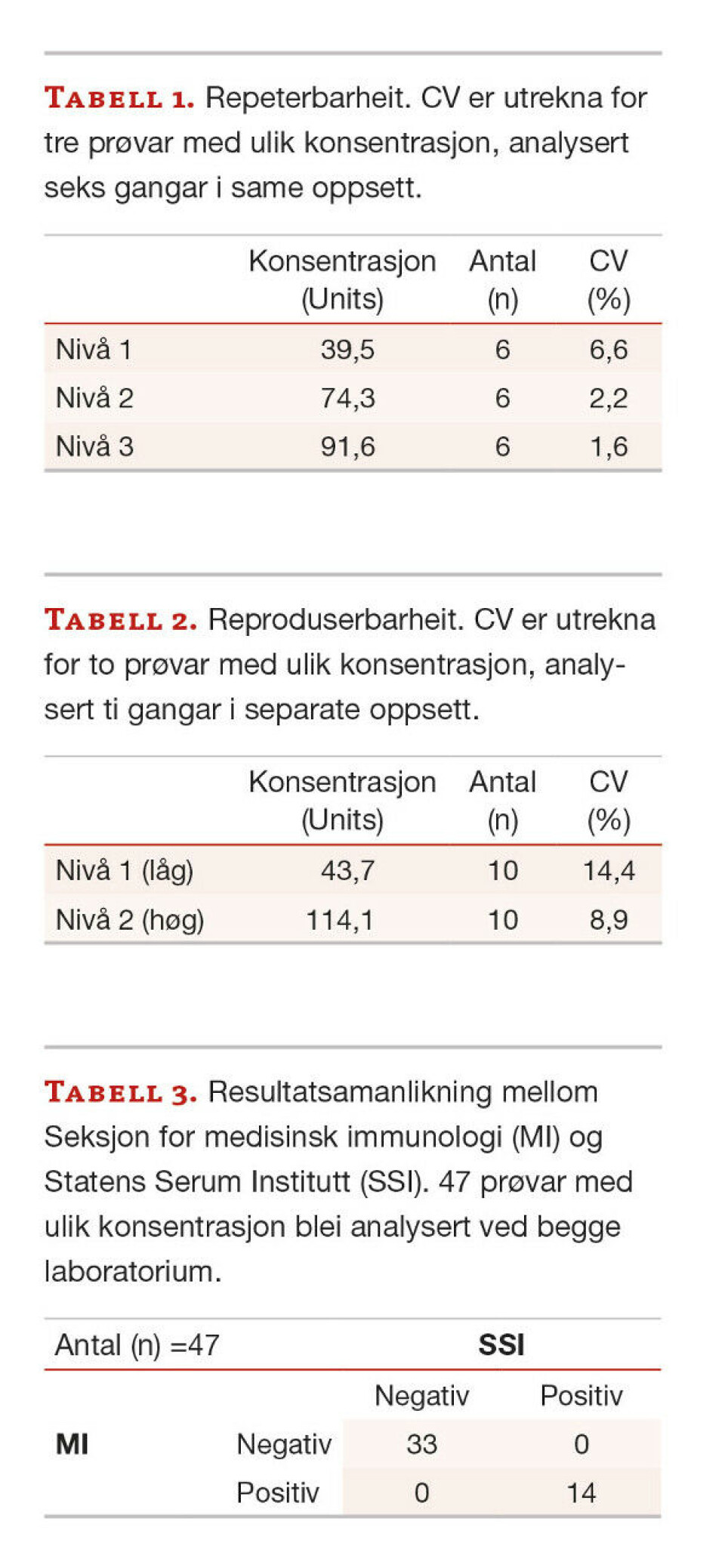
Repeterbarheit og reproduserbarheit til metoden verifiserast opp mot leverandøren. Dette gjerast ved å setje opp tre prøvar i ulike konsentrasjonsnivå (låg, middels og høg) seks gangar i eit oppsett for å måle repeterbarheit. For reproduserbarheit har vi laga to internkontrollar (låg og høg) av positive pasientprøvar. Krav til kvalitetsmål er at variasjonskoeffisienten (CV) skal vere mindre enn 20 %. Kvalitetsmåla er basert på krav sett av den internasjonale standarden (ISO 9001:2015), og dessutan ut frå observerte resultat frå leverandøren og tidlegare verifiserte/validerte analysar ved bruk av same metode.
Riktigheit
Verifisering av riktigheit blei utført ved å samanlikne resultata våre mot SSI i Danmark. Vi brukar den same metode og leverandør som SSI, og difor vil vi ha så lite variasjon som mogleg for at analysen skal vere godkjent. Krav for konsensus er satt på >85 %. I denne prosessen blei det inkludert totalt 14 positive prøvar og 33 negative serumprøvar frå pasientar. I tillegg blei 16 blodgjevarar testa.
Linearitet
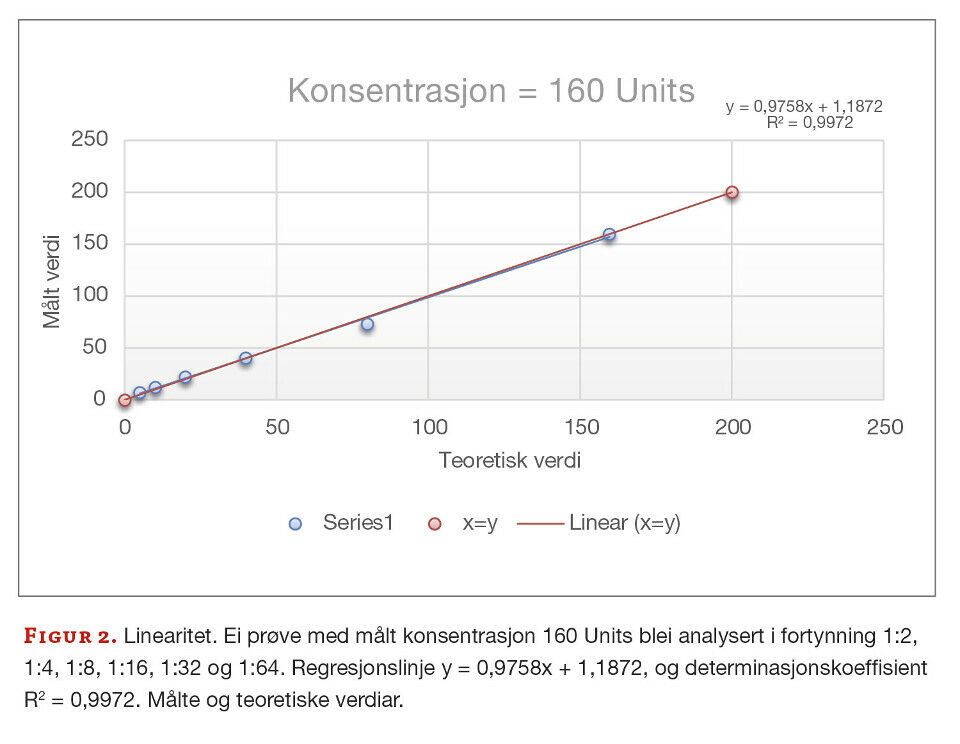
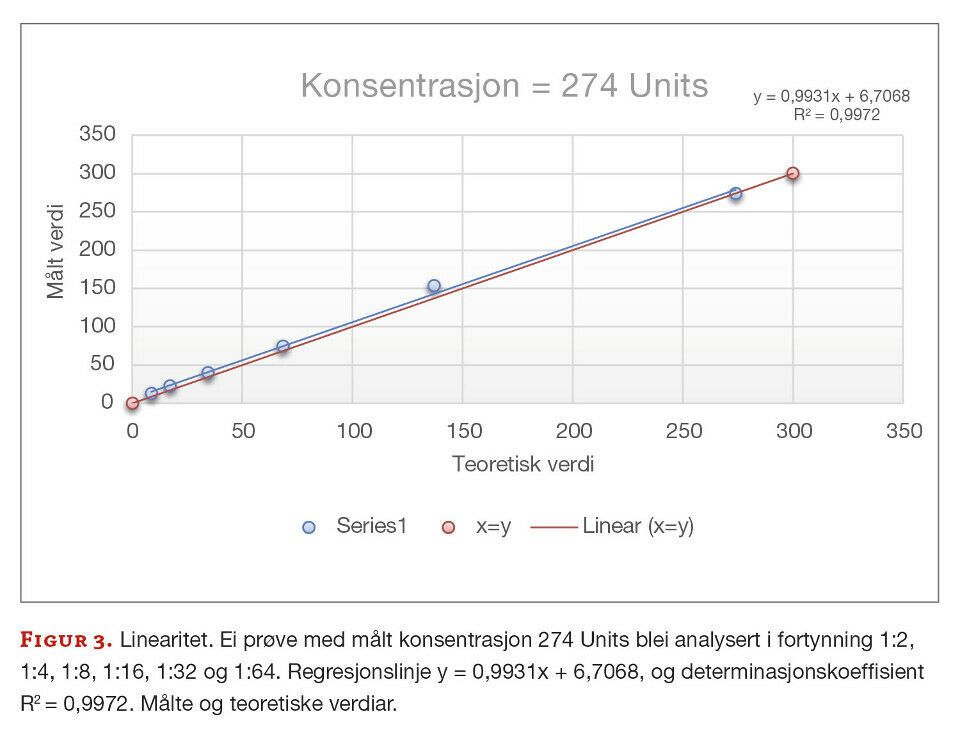
I følgje leverandøren er metoden lineær for prøvar som har konsentrasjon 3,1 - 200 Units. Dette skal vi verifisere ved å teste fortynningsrekker framstilt av prøvar med konsentrasjonar ved nedre og øvre kvantifiseringsgrense i ulike blandingsforhold. Det blei sett opp ein to-folds fortynning (1:2, 1:4, 1:8, 1:16, 1:32, 1:64) av fire prøvar (146 Units, 154 Units, 160 Units og 274 Units). Resultata plottast inn i eit spredningsdiagram med teoretiske verdiar på x-aksen og målte verdiar på y-aksen. Samanhengen vurderast visuelt og ved hjelp av lineær regresjon med minste kvadrats metode der y = ax + b. Målet er tilnærma lineær kurve kor stigningstallet (a) er tilnærma 1, konstantleddet (b) tilnærma 0, og god korrelasjon der determinasjonskoeffisienten (R2) er tilnærma 1.
Verifiseringsrapport
Rapporten inneheld resultata samt vurdering av verifiserte analyseparametrar. I rapporten skal vi også fylle ut om prosedyrar skal oppdaterast/opprettast. Vi må vurdere korleis informasjonen skal formidlast internt og eksternt, kva slags endringar som må gjerast i laboratoriedatasystem og om det skal lagast ein opplæringsplan.
Resultat for verifiserte parametrar
Presisjon
Resultat for repeterbarheit og reproduserbarheit kan vi sjå i tabell 1 og 2. Kvalitetsmål der CV skal vere mindre enn 20 % er oppnådd for dei ulike nivå. Som vist i tabell 1 og 2 er CV godt innanfor måla.
Riktigheit
Målet for riktigheit er >85 % konsensus. Det er 100 % konsensus mellom laboratoriet vårt og SSI (tabell 3). Kvalitetsmål på >85 % er oppnådd. Konsensus for både dei negative og positive prøvane er svært gode. Alle blodgjevarar var testa negative som forventa.
Linearitet og korrelasjon
Vi undersøkte om metoden er lineær i områda leverandøren har oppgitt. Ved visuell vurdering er det tydeleg at punkta ligg i ei rett linje for alle fire prøvane. Figur 2 og 3 er eksempla for dette. Prøva med konsentrasjon = 160 Units tilfredsstilte krava for linearitet med både stigningstal og konstantledd innanfor fastsette krav (figur 2). Prøva med konsentrasjon = 274 Units er stigningstallet tilnærma 1, men konstantleddet er 6,7 som er noko høgt i forhold til måla (figur 3). Ettersom 274 Units er utanfor områda leverandøren har oppgitt som lineært, så kan vi ikkje forventa at konstantleddet er tilnærma 0. Determinasjonskoeffisienten, R2, har verdiar tilnærma 1, som viser at det er veldig små avvik mellom dei målte og teoretiske verdiane (figur 2 og 3).
Resultata våre er svært gode og kvalitetsmåla er oppnådd, og difor kan vi implementere anti-HMGCR i rutinen vår. Vi følgjer anbefalingane frå leverandør om at resultat større enn 200 Units svarast ut som « >200 Units» med tekst på svarrapport «positiv», og «negativ» for resultat « <3 Units». Ein ny prosedyre for utføring av analysen er oppretta, og det blir gitt informasjon på eit seksjonsmøte at analysen er implementert. Vidare blir nettsidene våre oppdatert samtidig som det blir sendt eit «nyheitsbrev» til både interne og eksterne rekvirentar.
Konklusjon
Å verifisere nye analysar er ein krevjande prosess, særleg når analysen sjeldan er positiv. Verifiseringsprosessen av anti-HMGCR kravde planlegging i god tid. Analysen rekvirerast sjeldan og difor tok det to år å samle prøvar før vi kunne starte verifiseringa.
Resultata av verifiseringa er gode og tilfredsstillande ut frå dei målte parametrane som vi bestemte å verifisere. Frå 01.03.2018 er analysen innført i rutinen vår, og vi har observert vekst i rekvirering av analysen. Sida oppstart har vi i gjennomsnitt fått 15 prøvar i månaden for analysering.
Implementering av nye analysar er eit av måla til seksjonen for å tilfredsstille interessentar og behova til pasientane. Framtidige mål er å fortsette å innføre nye analysar, nye metodar og sørgja for eit oppdatert analyserepertoar innan autoantistoff, allergi, komplement og proteinanalyser.
Takk til Nermine Memeti som er valideringsansvarleg og Vidar Bosnes som er medisinskfagleg ansvarleg på seksjonen.
























