FAG Essay
Inflammatoriske tarmsykdommer og viromet
De fleste forbinder virus med sykdom, men mange virus lever evig i menneskelige verter uten å forårsake sykdom. Det personlige viromet etableres allerede ved fødselen og øker i mangfold utover i barneårene. Endringer i sammensetningen er assosiert med ulike sykdommer, som blant annet inflammatoriske tarmsykdommer.
Av MARIANNE DORÉ HANSEN
Iflammatoriske sykdommer og viromet.pdf(340 KB)
Virus i tarmen
Virus er i stand til å infisere alle levende organismer, fra planter til mennesker. Opprinnelsen til virus er ukjent, men de har antakeligvis vært med oss så lenge det har eksistert levende celler. Alle virus er fullstendig avhengige av vertscellen de infiserer for egen reproduksjon. En virusinfeksjon vil dermed kunne fremprovosere en immunrespons hos verten. Immunsystemet er en samling biologiske strukturer og prosesser i en organisme, som beskytter mot sykdom. Virus forårsaker mange sykdommer hos mennesker, fra relativt ufarlig influensa til dødelig ebola. Vi mennesker er svært forskjellige, og vi responderer også forskjellig på samme virussykdom. Det så vi tydelig under covid-19-pandemien. Noen ble svært alvorlig syke, mens andre bare så vidt fikk symptomer. I de fleste tilfeller vil immunsystemet eliminere viruset, men enkelte virus kan overliste immunsystemet og etablere en kronisk infeksjon. Gjennom koevolusjonen har virus kontinuerlig undersøkt cellens maskineri, for å finne nye måter å utnytte verten sin på.
Etableringen av tarmmikrobiomet i løpet av de første årene av livet spiller en sentral rolle i modningen av spedbarns immunsystem. En tidlig ubalanse i tarmmikrobiomet kan knyttes til en rekke kroniske sykdommer som oppstår senere i livet, noe som indikerer en varig effekt på immunprogrammeringen. Det er allment kjent at det er mange bakterier i økosystemet i tarmene våre. Men det er ikke så allment kjent at det faktisk er ti ganger så mange virus i tarmene våre som bakterier. Det er spesielt mange hos svært små barn, og de har ikke et fullt utviklet immunforsvar. Dette gjør at virus som ellers ville blitt uskadeliggjort kan være til stede. Men det er fortsatt et mysterium hvordan de mange virusene kommer inn i tarmen til disse spedbarna, siden tarmen vår er steril fram til vi blir født. Av virusene som vi finner i avføringsprøver er 90 prosent bakterievirus – også kalt bakteriofager. Det vil si virus som har bakterier som vertsceller. Bare 10 prosent av virusene i tarmen er eukaryote, noe som betyr at de bruker humane celler som verter. Mange av virusene vi finner i tarmen kommer fra maten og fra miljøet vi lever i, mens andre er såkalte provirus fra bakterier. Dette er et virus som er innebygd i DNA-et til vertscellene, altså bakteriene (1). Vi i CAG-IBD (Clinical Academic Group for Presisjonsmedisin i inflammatoriske tarmsykdommer) har nylig skrevet en omfattende oppsummeringsartikkel om virus-vert-interaksjoner i sykdomsutviklingen av ulcerøs kolitt (2).
Det fordelaktige viromet
Mage-tarm-kanalen kan betraktes som det organet som er mest utsatt for virus. I tillegg til den veletablerte rollen til tarmbakterier, har nyere studier begynt å avsløre at tarmvirus også er kritiske for homeostatisk regulering og sykdomsprogresjon. De virker via interaksjoner mellom både virus-bakterie (bakteriofager) og virus-vert (eukaryote virus). I motsetning til bakteriofager, kan eukaryote virus påvirke vertens immunrespons gjennom direkte interaksjon med medfødte immunsensorer i den infiserte epitelcellen.
Eukaryote virus, som begynner å kolonisere tarmslimhinnen tidlig i livet, tilhører familiene Adenoviridae, Anelloviridae, Astroviridae, Parvoviridae, Picornaviridae og Picobirnaviridae, og mangfoldigheten øker med alder.
Virale patogener av familiene Parvoviridae (humant bocavirus 2–4), Adenoviridae (adenovirus serotype 40 og 41), Caliciviridae (norovirus og sapovirus), Astroviridae (astrovirus), Picornaviridae (entero-, kobu- og parechovirus), Coronaviridae (alvorlig akutt respiratorisk syndrom [SARS] og SARS–CoV-2), Hepeviridae (hepatitt E-virus) og Reoviridae (rotavirus) kan forårsake akutt gastrointestinal sykdom. Men det finnes eukaryote virusfamilier i tarmen som ikke har klare roller som patogener. Tidligere studier har dokumentert vedvarende utskillelse av enteriske eukaryote virus fra Anelloviridae (Torque teno-virus), Circoviridae (uklassifisert), Picobirnaviridae (picobirnavirus) og Picornaviridae (humant parechovirus 1) hos friske spedbarn eller barn, uten at tilstedeværelsen forårsaker symptomatisk sykdom. Fraværet av symptomer kan reflektere enten en kommensal virusinfeksjon uten tilsynelatende skade på verten eller at immunsystemet undertrykker effekter av infeksjonen.
Virusfamilien Anelloviridae er allestedsnærværende og infiserer mest sannsynlig hele den menneskelige befolkningen, enten kronisk eller ved kontinuerlig reinfeksjon. På tross av dette er det ikke påvist en sykdomssammenheng. Det er derfor mulig at disse virusene kan ha en potensiell gunstig effekt på menneskers helse. Som i tilfellet med et balansert tarmbakteriemiljø som er nødvendig for en sunn tarm, kan Anelloviridae-populasjonen være en del av en personlig virusflora som påvirker menneskets fysiologi positivt; «det fordelaktige viromet».
I tillegg kan også sykdomsfremkallende virus detekteres i avføringsprøver i fravær av symptomer. Rotavirus og parvovirus er observert hos friske barn. Norovirus kan detekteres i asymptomatiske individer over lange perioder. Til og med SARS-CoV-2, viruset som er ansvarlig for covid-19-pandemien, kan infisere tarmepitel og påvises i avføring i minst 1–2 måneder - selv med asymptomatisk infeksjon. Selv om disse asymptomatiske virusinfeksjonene normalt ikke forårsaker påvisbare fenotyper i vertene deres, samhandler de vedvarende med vertens immunsystem. De kan bidra til å opprettholde styrkende nivåer av beskyttende immunitet eller omvendt øke vertens mottakelighet for sykdom, avhengig av kontekst.
Virusgenetikk
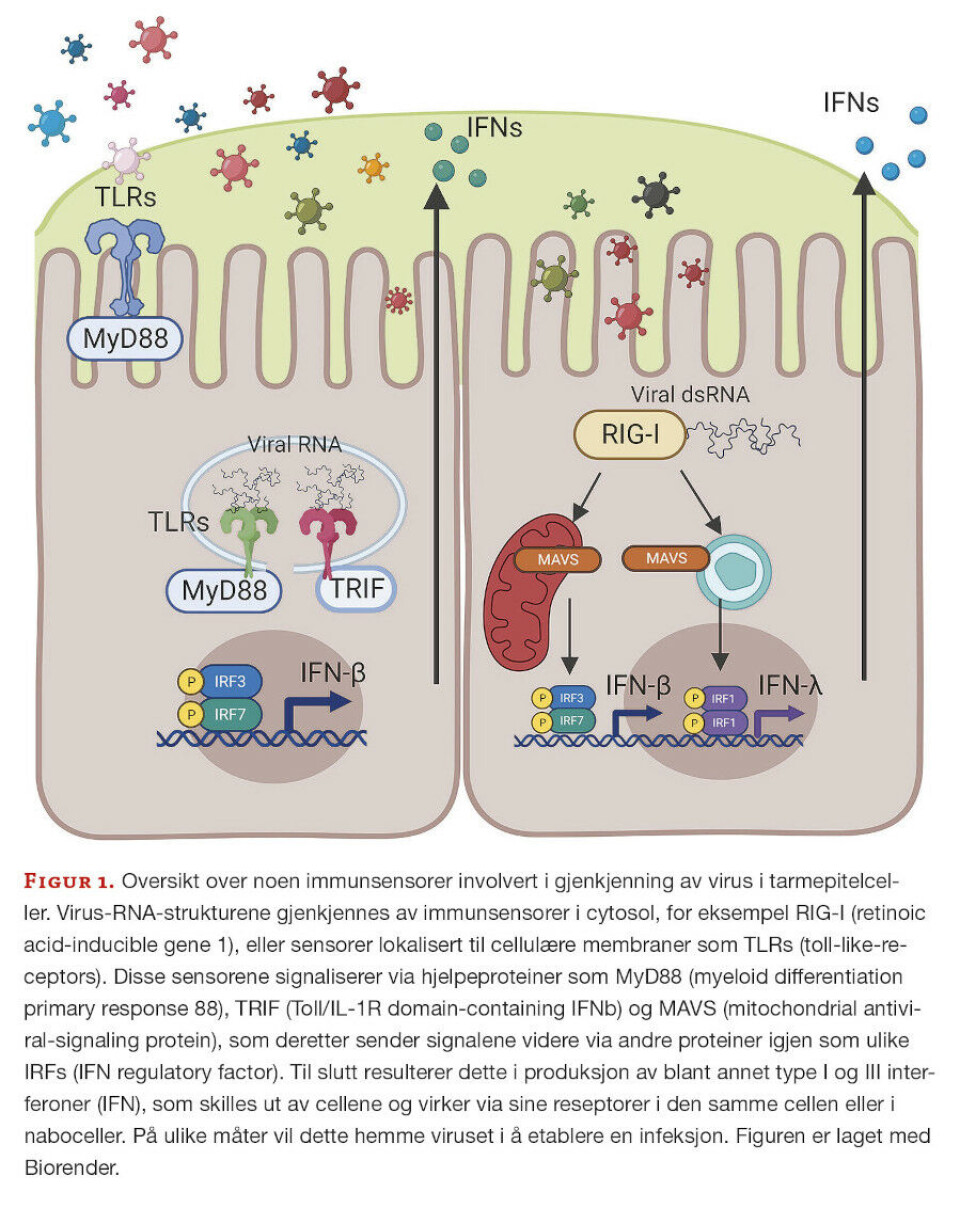
Virus kan ha RNA og DNA som arvestoff, men aldri begge samtidig. Virusgenetisk materiale har en høyere diversitet enn noen annen organisme, inkludert bakterier. Det virale RNA og DNA kan bestå av en eller to tråder (enkelt- eller dobbelttrådet), være sirkulært eller lineært, og bestå av mange individuelle segmenter eller som et kontinuerlig segment. Blant organismer som lever i dag er det kun virus som har RNA som arvestoff, og de aller fleste virusfamiliene vi finner i tarmen har RNA som genetisk materiale. Disse RNA-strukturene gjenkjennes av immunsensorer. En oversikt over immunsensorer involvert i gjenkjenning av virus i tarmepitelceller er vist i figur 1.
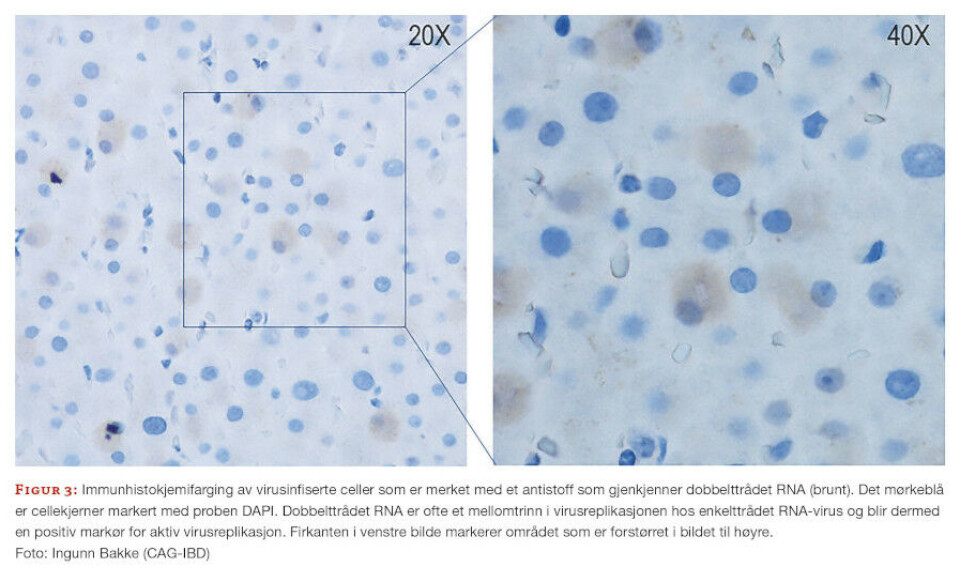
Inflammatorisk tarmsykdom og tarmviromet
Inflammatorisk tarmsykdom (IBD) er en samlebetegnelse på kroniske betennelsessykdommer som rammer tarmkanalen og omfatter blant annet Crohns sykdom og ulcerøs kolitt. IBD rammer ofte unge mennesker og forekomsten i vestlige land er tydelig økende. Sykdomsforløpet er svært varierende; fra milde og sjeldne forverringer til utbredt og alvorlig tarmbetennelse som krever omfattende medikamentell behandling og gjentatte, kirurgiske inngrep. Sykdommen er i stor grad uforutsigbar. Tidlig diagnose og identifisering av risikofaktorer for alvorlig sykdom er viktig for å kunne gi tilpasset behandling. Patogenesen bak IBD er ikke kjent, men den ledende hypotesen er at det oppstår en feilaktig immunrespons mot tarmens mikrobiota i genetisk predisponerte individer. Den raskt økende forekomsten av IBD i vestlige land indikerer at miljøfaktorer kan spille en viktig rolle. Virus har lenge vært en neglisjert faktor i studiene på IBD-patogenese, til tross for høy forekomst og diversitet i tarmen.
Når immunforsvaret aktiveres av virus initieres en rekke prosesser i organismen som beskytter mot sykdom. Det foregår en rask frigjøring av cytokiner og produksjon av effektorkomponenter, som blant annet fører til betennelse eller inflammasjon. Hensikten er å begrense virusets evne til å reprodusere seg selv og dermed kunne spre infeksjonen til nabocellene. Slike immunresponser er nøye regulert for å hindre en overreaksjon som vil være skadelig for vertsorganismen. Dersom en slik immunrespons ikke er balansert, kan den resultere i kronisk tilstand av betennelse.
En interessant studie av Adiliaghdam og kollegaer (3) undersøkte om virusfamilier i tykktarmsvev fra pasienter med IBD satte i gang en annen immunrespons enn virusfamilier i tykktarmsvev fra individer uten IBD. De fant at virusfamiliene fra individer som ikke har IBD fremkalte en anti-inflammatorisk immunrespons (IL 10), mens virusfamiliene fra IBD-pasienter fremkalte en pro-inflammatorisk respons (IL 6). Interleukin 10 (IL 10) er et anti-inflammatorisk cytokin som spiller en avgjørende rolle for å forhindre inflammasjon og som har immundempende effekter, mens interleukin 6 (IL 6) kan fungere mer som et pro-inflammatorisk cytokin som dikterer overgangen fra akutt til kronisk betennelse ved å påvirke infiltreringen av leukocytter. Sammen gir funnene i denne studien et funksjonelt bevis på at de kollektive virusene i en normal/ikke-betent tarm kan bidra til å bygge tarmimmunitet hos mennesker - en kontrast til misforståelsen om at alle virus er skadelige. Derfor vil en endring i tarmviromet, eller en feilaktig immunreaksjon på grunn av genetisk variasjon i virussensorer (som tap-av-funksjon-mutasjoner i reseptoren MDA5), ha skadelige konsekvenser for menneskets tarm og kan bidra direkte til IBD-fenotype.
Gastrointestinale organoider – ex vivo modellsystem
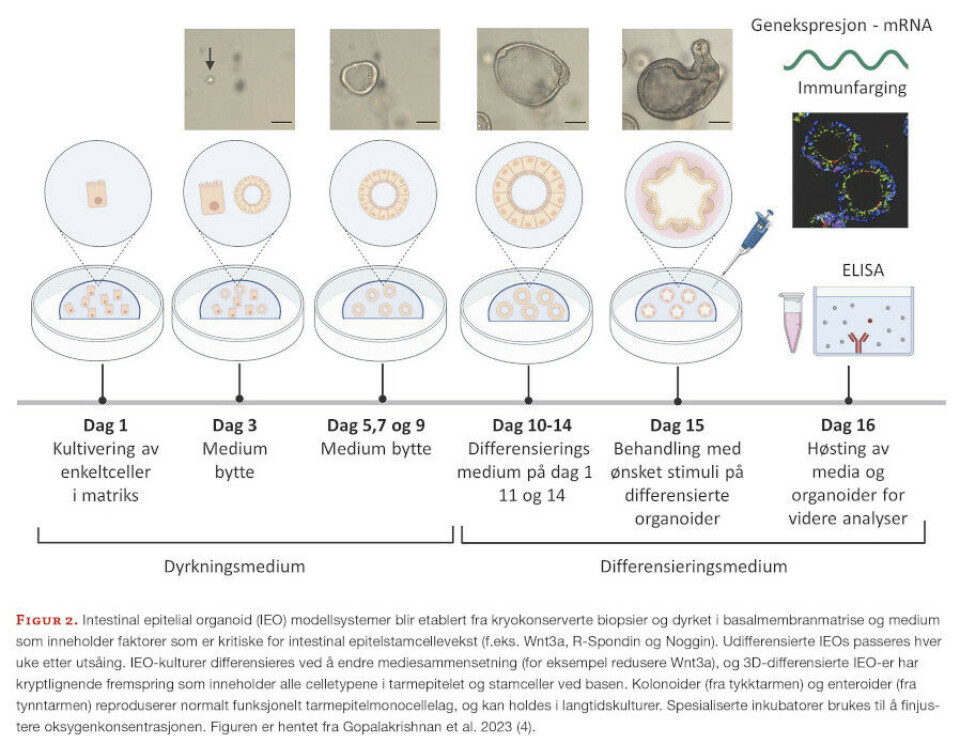
Det humane gastrointestinale epitelvevet er et bemerkelsesverdig dynamisk, cellulært mangfoldig og histologisk intrikat system underlagt tett regulering. Det må absorbere næringsstoffer i kosten for å gi næring til hver enkelt celle i menneskekroppen, men det må også danne en beskyttende barriere mot den enorme mengden av patogene organismer som kommer inn i tarmen. Humane intestinale organoider er et viktig verktøy når man studerer interaksjoner mellom virus og vert. Organoidene er stamcellederiverte ex vivo kultursystemer som rekapitulerer det cellulære mangfoldet til det humane tarmepitelet. De opprettholder en tett, polarisert epitelbarriere og regulert sekretorisk aktivitet. Derfor har organoidmodellen blitt et verdifullt verktøy for funksjonelle studier også for å studere virus-vert-interaksjoner. Oversikt over arbeidsflyten i vårt intestinal epitelial organoid (IEO) modellsystem er vist i figur 2 og beskrevet i detalj i en ny artikkel fra CAG-IBD-gruppen (4).
Virus er viktig for helsen vår
Det er viktig å påpeke at selv om mange assosierer virus med noe negativt på grunn av enkelte virus sin evne til å gjøre oss syke, er mange virus faktisk våre venner. Vi mennesker er fulle av virus, og derfor er det antakelig bare noen få som er skadelige for oss. Tarmmikrobiomet formes gjennom spedbarnsalderen, påvirker modningen av immunsystemet og kan derfor spille en rolle i beskyttelsen mot kronisk sykdom senere i livet. Tarmvirus har tidligere vært antatt å være skadelige eller nøytrale for verten, men viromet i tarmen kan ha en rolle i å fremme beskyttende immunitet under betennelsestilstander. I tillegg kan en dysregulering av tarmslimhinnens immunrespons mot virus utløse overdreven patologisk betennelse. Derfor er det viktig at vi nå også fokuserer på rollen de mange virusene i tarmen spiller for immunforsvaret og helsen vår. Vi blir stadig mer bevisste på at det finnes bakterier som er viktige for å opprettholde en god tarmhelse, og vi må begynne å se virus på samme måte.
Virusene, bakteriene og immunsystemet påvirker antagelig hverandre i en eller annen form for balanse. Og hvis det er ubalanse i det forholdet, øker det sannsynligvis risikoen for kroniske sykdommer. Ytterligere forskning på dette feltet er høyst nødvendig for å definere bidraget fra virus til tarmimmunitet, så vel som til utvikling av tarmsykdommer og andre komplekse inflammatoriske lidelser. Figur 3 viser en av mange metoder vi har for å detektere virus i celler.