FAG Kronikk
Interferens fra heterofile antistoffer i immunometriske analyser
Immunoassayets fortreffelighet og sårbarhet
Rosalyn S. Yalow og Solomon Berson publiserte i 1959 en kort artikkel i tidsskriftet Nature som beskrev en ny metode, et radioimmunoassay (RIA), for å måle insulinnivået i blod (1).
Metoden baserer seg på at insulinet i pasientprøven, som har ukjent konsentrasjon, må konkurrere med tilsatt radioisotopmerket insulin om binding til et insulinspesifikt antistoff. Etter at ubundet insulin er fjernet ved vask eller presipitering, kan styrken på signalet, det vil si antall disintegrasjoner per tidsenhet eller ”strålingen” fra den radioaktive isotopen, måles og sammenlignes med en standardkurve. Det målte signalet er omvendt proporsjonalt med mengden insulin som er til stede i pasientprøven.
Yalow og Bersons metode var robust og relativt enkel, og milevis foran eksisterende metoder når det gjaldt sensitivitet og spesifisitet. Det sentrale fortrinnet til dette analyseprinsippet er utnyttelsen av en overlevelsesstrategi som dyreriket brukte hundrevis av millioner år på å utvikle (2): Det adaptive immunforsvaret og dets evne til å lage spesifikke antistoffer med høy affinitet for antigener som dyr og mennesker eksponeres for.
Immunoassayet muliggjør rask, presis og repeterbar konsentrasjonsbestemmelse av peptider og proteiner som finnes i svært lave konsentrasjoner (pmol/L, og i noen tilfeller enda lavere) i komplekse væsker som plasma. Ingen andre målemetoder kan per i dag konkurrere med immunoassays.
Det hører med til historien at Yalow og Berson nektet å patentere metoden. De ønsket at teknikken skulle komme medisinen og menneskeheten til gode. I dag benyttes hundrevis av immunoassays. De baserer seg på de samme hovedprinsippene som Yalow og Bersons opprinnelige kompetitive RIA, og de brukes til å diagnostisere og kontrollere en rekke sykdommer og tilstander. Selv om immunometriske analyser vanligvis foretrekkes i dagens analyseinstrumenter (se figur 1), er fortsatt kompetitive assays dominerende for enkelte analytter, for eksempel steroidhormoner.
Det er vanskelig å se for seg moderne medisin uten muligheten for rask og presis analyse av hjertemarkører, betennelsesmarkører, infeksjonsserologi, hormoner, tumormarkører; analyser hvor immunoassayet er det totalt dominerende analyseprinsipp. I så måte var det neppe ufortjent at Rosalyn Yalow (Berson døde i 1972) fikk Nobelprisen i medisin i 1977 for utviklingen av immunoassay-teknologien.
Biologiske trusler
Det ble tidlig klart at immunoassays designet for bruk i medisinske laboratorier var utsatt for trusler fra biologien. Noen utfordringer ble man raskt klar over, som at flere biomarkører (særlig hormoner) ligner hverandre i så stor grad, eller eksisterer i så vidt ulike molekylære varianter, at analysene og klinikerne kan bli lurt. Kjente eksempler er at TSH, hCG, FSH og LH kan kryssreagere i hverandres analyser (3), og at de ulike CEA-analysene (CEA = karsinoembryonalt antigen) har en høyst varierende evne til å måle CEA-varianten NCA-2 (4).
Et tredje eksempel er de ulike hCG-analysenes varierende spesifisitet og evne til å måle de ulike variantene av hCG som blant annet finnes i ulike forhold på ulike tidspunkter ved henholdsvis normale og unormale graviditeter, hos postmenopausale kvinner og ved ulike kreftsykdommer (5). Per i dag finnes det seks WHO-standarder for ulike hCG-varianter.
Disse eksemplene illustrerer noe av kompleksiteten som utviklere, selgere og brukere av immunoassays må forholde seg til. Siden vi har ervervet oss mye kunnskap om molekylstruktur, antistoffspesifisitet og analysedesign, er imidlertid disse utfordringene etter hvert blitt rimelig forutsigbare og håndterbare.
Lumske antistoffer
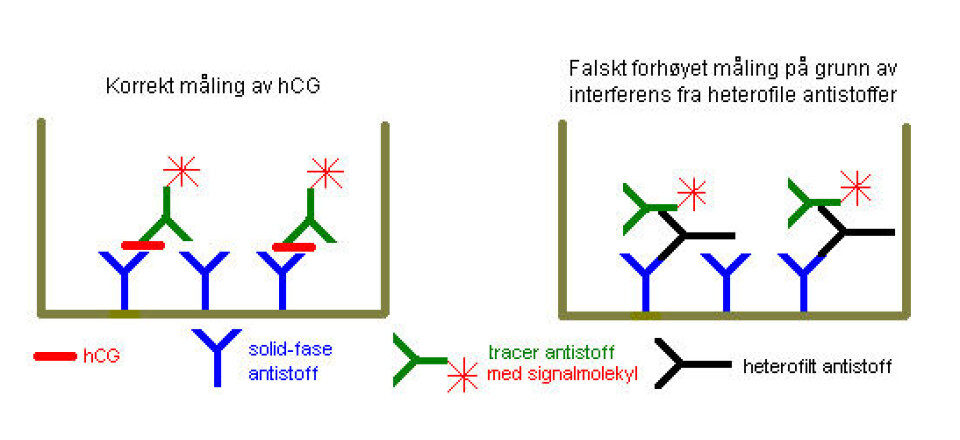
En langt mer lumsk trussel mot immunoassays er heterofile antistoffer (6,7) (i begrepet inkluderer vi også det som vanligvis kalles humane anti-mus antistoffer, HAMAs, som oppstår etter kjent eksponering for terapeutiske eller diagnostiske museantistoffer). Forenklet kan heterofile antistoffer defineres som antistoffer i pasienters blod med potensial til å interferere i våre immunoassays (se figur 1).
Paradoksalt nok er også disse et produkt av vårt adaptive immunsystem, men det er vanskelig å slå fast hvorfor de produseres eller hvilken nytte vi har av dem. Det sikreste vi kan si om heterofile antistoffer og deres plass i immunforsvaret i denne sammenheng, er at de illustrerer den imponerende kompleksiteten i immunapparatet vårt.
Heterofile antistoffer kan forstås som en type polyreaktive eller polyspesifikke antistoffer som kan ha en funksjon i et adaptivt immunforsvar, og som i noen tilfeller kan modnes til monospesifikke antistoffer, avhengig av eksponering for antigen (8).
Dersom slike polyreaktive antistoffer binder antistoffene som brukes i våre analyser, får vi det vi kaller heterofile antistoffer med evne til å gi falske analysesvar. Her spiller ikke biologien på lag med immunoassayister, da polyreaktive antistoffer påfallende ofte har affinitet for andre antistoffer, og da særlig Fc-delen på antistoffene (9).
Hos noen pasienter er produksjonen av heterofile antistoffer forbigående og tilsynelatende antigendrevet (10). Hos andre pasienter virker produksjonen av det problematiske antistoffet å være permanent.
Hva bør produsentene gjøre?
Produsentene av immunoassays kan redusere problemet med interferens fra heterofile antistoffer ved hjelp av relativt enkle grep. Tidligere tilsatte firmaene stort sett urenset ikkehumant serum til analysereagensene, mens det i dag er vanlig å tilsette renset bovint serumalbumin (BSA), bovint IgG, og ofte et irrelevant blokkerende antistoff fra samme dyreart som analyseantistoffet er hentet fra.
I praksis betyr det at dersom en hCG-analyse er laget med monoklonale museantistoffer (mot hCG), kan analysen beskyttes med et annet museantistoff som ikke binder hCG. Det tilsatte antistoffet er en mer effektiv blokker dersom det er aggregert, enten kjemisk eller ved varme (10), sannsynligvis fordi de heterofile antistoffene danner mer stabile komplekser med slike aggregater (flere bindeseter/epitoper) enn med ikke-aggregert antistoff.
Det er også viktig at det blokkerende antistoffet ligner analyseantistoffene i størst mulig grad. Det betyr at dersom analyser benytter monoklonale museantistoffer av IgG1-type, som er vanligst, bør det blokkerende antistoffet også være monoklonalt museantistoff av IgG1-type. Er analyseantistoffet polyklonalt kaninantistoff, bør det blokkerende antistoffet også være det. Dersom analysen er laget med et monoklonalt museantistoff kombinert med polyklonalt kaninantistoff, må begge typer blokkerende antistoff tilsettes.
En sjelden gang ser vi at analyser som benytter musemonoklonaler kun er beskyttet med for eksempel geiteserum (eller udefinert ”dyreserum”), som jo er billigere og lettere tilgjengelig enn irrelevante monoklonale antistoffer fra mus. I slike tilfeller kan et heterofilt antistoff med høy affinitet for museantistoffer (for eksempel et HAMA) binde analyseantistoffene fremfor de tilsatte geiteantistoffene. Analyseresultatet kan dermed bli falskt forhøyet.
Fjern Fc-delen
De aller fleste heterofile antistoffer som skaper problemer i analysene våre binder seg til Fc-delen av analyseantistoffene (10;11). I biologien er Fc en svært viktig del av antistoffet, men i de fleste analyser er den eneste betydningen at den bidrar til økt uspesifikk binding (økt blank/bakgrunn) eller interferens. Det mest effektive enkelttiltaket er derfor å fjerne Fc-delen.
På Sentrallaboratoriet ved OUS-Radiumhospitalet har vi fjernet Fc fra analyseantistoffene i våre hjemmelagde analyser i mer enn 10 år. Vi oppdaget at det var helt nødvendig for å få god beskyttelse mot interfererende antistoffer (10).
Enkelte kommersielle analyseprodusenter gjør det samme i noen av sine analyser, og bruker kun F(ab’)2 eller Fab’-fragmenter, men disse utgjør dessverre unntakene. En viktig grunn til at intakt IgG fortsatt dominerer i kommersielle analyser, er kostnader. Antistoffer er relativt dyre og utgjør en betydelig del av produksjonskostnadene, enten firmaene produserer selv (på lisens) eller kjøper ferdig antistoff. Noe tap av antistoff må påregnes ved spalting til F(ab’)2 eller Fab’-fragmenter (vi regner i snitt cirka 25 prosent tap med metoden vi bruker), og firmaenes totale produksjonskostnader vil øke.
For fortsatt å kunne tjene penger på analysene, må kitprisene settes opp. Dette er åpenbart en større bekymring for kommersielle analyseprodusenter som blant annet konkurrerer på pris, enn det er for et laboratorium som lager egne antistoffer til bruk i in-house analyser.
Omfattende søknadsprosesser
En annen årsak både til at intakt IgG fortsatt dominerer i kommersielle analyser, og at reagensene ofte ikke er tilsatt adekvat blokker, er paradoksalt nok kvalitetskravene analyseprodusentene må forholde seg til. Før firmaene kan selge og markedsføre en analyse i USA, må de ha godkjenning fra U.S. Food and Drug Administration (FDA). Søknadsprosessen fram mot en slik godkjenning er nesten like omfattende for nye analyser som for nye medikamenter (12), og firmaene bruker betydelige ressurser på slike søknader.
I noen tilfeller, for eksempel for analyser der firmaene ikke forventer å selge mange nok kit til å veie opp for innsatsen en slik søknad krever, holdes analysene tilbake fra det amerikanske markedet. Firmaene bruker heller ressursene på markedsføring i resten av verden. Når en analyse først er godkjent av FDA, er firmaene bundet opp i den eksisterende godkjenningen, og kan ikke gjøre vesentlige endringer i analysen uten å gå gjennom en ny søknadsrunde.
Firmaene velger noen ganger heller å fortsette med analyser de vet er dårlig beskyttet, og kanskje risikere et dårlig rykte og til og med erstatningssøksmål, enn å endre analysen og dermed måtte gå gjennom en ny søknadsprosess.
Mulige tiltak
Heterofile antistoffer er som nevnt en lumsk trussel. Det er sjelden grunn til å mistenke denne typen interferens før analysen utføres, slik tilfellet er ved lipemi og ikterus. Analyseinstrumenter gir dessuten ikke feilmeldinger eller advarsler om heterofile antistoffer i prøven. Å få til det siste høres kanskje urealistisk ut, men en relativt ny artikkel i Clinical Chemistry beskriver faktisk et immunoassay med innebygget interferenstest (13).
Oftest oppstår mistanken om interferens når klinikere kontakter laboratoriet fordi et analyseresultat ikke passer med pasientens sykdomsbilde (14,15). Misforholdet skyldes (noe forenklet) enten at laboratoriet har gitt ut et uriktig resultat, eller at legen oppfatter pasientens sykdomsbilde feil. Slike meldinger må tas på alvor, og det er viktig at laboratoriet og klinikeren samarbeider om å finne årsaken til uoverensstemmelsen. Det kan få uheldige konsekvenser for pasienten, men også for samarbeidet og tillitsforholdet mellom lege og laboratorium, dersom slike saker forblir uavklart.
Reanalyse og blokkering
Det første laboratoriet må forsikre seg om dersom det er sannsynlig at feilen ligger på laboratoriesiden, er at prøven ikke er forbyttet. Deretter bør prøven reanalyseres med samme metode for å utelukke en tilfeldig målefeil. Er resultatet fortsatt avvikende, anbefaler vi at prøven reanalyseres med en annen metode hvis det er mulig.
Reanalysering etter fortynninger kan også bidra til å avsløre interferens, men tolkningen kan være vanskelig, og det er viktig å kjøre parallellfortynning av en sant forhøyet prøve (16). Ulike typer blokkere av heterofile antistoffer kan tilsettes prøven før reanalysering, men da er det nødvendig med kunnskap både om hvordan analysen er designet og om blokkerens egenskaper.
I tillegg finnes det mer krevende metoder for spesielt interesserte, som PEG-felling, gelfiltrering, affinitetskromatografi, non-sense analyser osv. Det er vanlig å si at en negativ interferenstest ikke beviser noen ting, mens en positiv interferenstest oftest betyr at det opprinnelige resultatet var feil. Det er viktig at forskjeller som for eksempel skyldes ulik kalibrering/ulik spesifisitet i ulike assays, eller manglende linearitet, ikke tolkes som positiv interferenstest. Derfor er det en fordel, uansett hvilken test man velger, at man har noe erfaring med utførelse og tolkning av testen (17).
Kontakt oss!
Ikke alle laboratorier har utstyr, kapasitet eller erfaring til grundig etterprøving av alle tvilsomme immunoassayresultater, i hvert fall ikke uten hjelp. På OUS-Radiumhospitalet har vi nødvendig utstyr og erfaring til å løse de fleste såkalte problemprøver vi får tilsendt. Vi har i tillegg stor interesse for immunoassays og interferens, og vi tar gjerne imot flere slike henvendelser. Interessen og erfaringen stammer blant annet fra mangeårig produksjon av monoklonale antistoffer til bruk i våre hjemmelagde immunometriske analyser for en rekke tumormarkører. Vi oppfordrer både klinikere og laboratorieansatte til å ta kontakt med oss ved behov for hjelp eller ved spørsmål rundt mulig interferens i immunometriske analyser. Vi vil også nevne at Hormonlaboratoriet på OUS-Aker har særlig kompetanse når det gjelder hormonanalyser og de ulike interferensene som er aktuelle, og til dels unike, for disse analysene.
Vær på vakt!
Hos noen pasienter kan det være god grunn til å være ekstra mistenksom allerede før prøven analyseres. Det gjelder særlig pasienter som tidligere har fått påvist interferens fra heterofile antistoffer eller som har hatt uforklarlige resultater fra immunoassays. Årsaken til dette er kort fortalt at antistoffene som i dag benyttes i kommersielle immunoassays ligner hverandre i betydelig grad. De aller fleste er musemonoklonaler av IgG1-type fra hunndyr fra musestammen BALB/c, en stamme laboratoriemus som er innavlet siden 1920-tallet.
Særlig Fc-områdene, som ikke inneholder variable domener, er svært like i de forskjellige antistoffene. Det er derfor viktig at både pasienten og pasientens lege får tydelig beskjed, helst skriftlig, dersom et falskt resultat skyldes interferens fra heterofile antistoffer. Slik kan fremtidige misforståelser og uheldige hendelser unngås.
I tillegg kan pasienter med revmatisk sykdom, særlig de med høy reumatoid faktor, ha noe høyere sannsynlighet for denne typen interferens. Det skyldes at det reumatologene kaller reumatoid faktor, er en type antistoff med egenskaper (IgM/IgG med affinitet for Fc-delen av IgG) som ligner heterofile antistoffers egenskaper.
Humaniserte monoklonale antistoffer
En pasientgruppe det er all mulig grunn til å følge i tiden fremover, er de som behandles med humaniserte monoklonale museantistoffer. Slike terapeutiske antistoffer omtales ofte som ”biologiske legemidler”, et lite dekkende begrep (18). Humanisering av et monoklonalt museantistoff innebærer at mest mulig (ofte mer enn 95 prosent) av museproteinet, som immunsystemet vårt jo i utgangspunktet vil oppfatte som fremmed, gjøres mer likt antistoffer som forekommer naturlig hos mennesker. På denne måten håper produsentene at antistoffet kan gis til pasienter uten at det setter i gang en immunreaksjon.
Humaniserte antistoffer gis vanligvis endelsen –zumab, mens kimære antistoffer, der det bare er museantistoffets Fc som er erstattet med human Fc, vanligvis gis endelsen –ximab. Selv om mer enn 95 prosent av museantistoffet er erstattet av humane sekvenser, er det fortsatt museprotein igjen, og det er sannsynlig at enkelte pasienter vil danne antistoffer mot det terapeutiske antistoffet. Vi antar at det er dette som skjer hos noen pasienter der effekten av det terapeutiske antistoffet forsvinner etter noen behandlinger.
Vi forventer at noen av disse pasientene også vil danne antistoffer som kan interferere i immunologiske analyser, sannsynligvis med andre egenskaper enn de heterofile antistoffene vi ser i dag. Bruken av terapeutiske monoklonale antistoffer er allerede veletablert ved enkelte kreftsykdommer, og også hos pasienter med alvorlige betennelsessykdommer i hud, ledd og gastrointestinaltraktus. Lovende resultater fra utprøvende behandling ved andre lidelser, for eksempel myalgisk encephalopati (ME), bærer bud om at indikasjonslisten vil utvides i årene fremover. Det gjenstår å se om dette vil medføre nye utfordringer og kreve nye løsningsstrategier for laboratoriene.
En oppsummering og en formaning
Det er først og fremst analyseprodusentene som kan redusere problemet med interferens fra heterofile antistoffer i immunometriske analyser (19). Det er sannsynlig at problemet aldri blir helt borte, men det skal relativt liten innsats til for å forbedre mange av analysene som benyttes i dag.
Vi undersøkte nylig hvor sårbare 170 ulike kommersielle analyser var for to pasientsera som inneholdt Fc-reaktive (altså den vanligste typen) heterofile antistoffer. Resultatene var nedslående. Av de 170 analysene vi testet, ga 21 falske resultater (20). Disse falske resultatene kunne vært unngått dersom produsentene enten hadde fjernet Fc fra analyseantistoffene eller tilsatt aggregert muse-IgG til reagensene.
Vi mener at disse 21 analysene, basert på det vi i dag vet om analysedesign og blokkering av antistoffinterferens, i praksis mangler spesifikk beskyttelse mot heterofile antistoffer. Det betyr at sannsynligheten for unødvendig utredning og behandling av pasienter som egentlig ikke trenger det, slik som i historien som innleder denne kronikken, fortsatt er uakseptabelt høy, med de kostnader det kan ha for både pasienter og helsevesen.
Det er ganske sikkert ikke uvitenhet, men heller strategisk ressursbruk og profitthensyn, som gjør at firmaene fortsatt markedsfører sine gamle og sårbare analyser. Tross alt er det ikke så farlig om kua halter så lenge den fortsatt produserer melk.
Som laboratorieleger og bioingeniører kan vi gjerne gjøre firmaene kjent med vår misnøye og indignasjon, men det er tvilsomt at det vil hjelpe. Dersom vi derimot slutter å kjøpe analyseinstrumentene og analysene som beviselig er dårlig beskyttet mot interferens, vil firmaene sannsynligvis høre bedre etter. Det bør være opp til produsentene å dokumentere at deres metoder er så godt beskyttet mot heterofile antistoffer som det innen rimelighetens grenser er mulig å få til.
Etter vår mening betyr det at antistoffene som benyttes i analysene skal ha fjernet Fc, og at reagensene er tilsatt tilstrekkelig aggregert immunglobulin av samme type som analyseantistoffene.
Derfor oppfordrer vi alle til å unngå ikke bare analyser som erfaringsmessig er særlig utsatt for interferens, men også analyser der firmaet ikke kan eller vil dokumentere hvordan analysen er designet og beskyttet. Det handler om våre pasienters sikkerhet, deres tillit til helsevesenet, og vår egen faglige stolthet og integritet.
























