FAG i praksis
Interferens i immunologiske metoder – erfaringer fra en laboratoriehverdag
Ulike faktorer kan medføre usikkerhet i analyseresultatene. For immunologiske metoder er det spesielt viktig å være klar over analysemetodenes begrensninger og kjenne til hva som kan interferere i analysen.
Av SIRI BEISLAND MORTENSEN, bioingeniør/seksjonsleder, Seksjon for immunologi, Tverrfaglig laboratoriemedisin og medisinsk biokjemi, Akershus universitetssykehus HF
Interferens i immunologiske metoder – erfaringer fra en laboratoriehverdag.pdf(628 KB)
Seksjon for immunologi, ved avdeling for Tverrfaglig laboratoriemedisin og medisinsk biokjemi på Akershus universitetssykehus HF, har et stort analyserepertoar innen flere fagområder. Analysemetodene er heterogene immunoassay, der man utnytter at spesifikke antistoffer kan gjenkjenne og binde seg til bestemte antigener. Ved hjelp av signalmerkete antistoffer og en form for fast fase, kan man med ulike teknikker separere bundet fra ubundet materiale og dermed påvise og kvantitere både antigener og antistoffer.
For analyser innen allergi og autoimmunitet, påvises ulike typer antistoffer. I infeksjonsserologi kan vi påvise og kvantitere både antistoffer og antigener. I tillegg bruker vi immunoassay til påvisning og kvantitering av hormoner, vitaminer, medikamenter, hjerte- og tumormarkører.
I analysedokumentasjonen fra produsent er det som regel en oversikt over mulige interfererende stoffer som kan påvirke analyseresultatet. I noen tilfeller kan man derfor forebygge, og i andre tilfeller informere rekvirenten dersom vi mistenker interferens. Reagensprodusentene jobber med kontinuerlig utvikling og forbedring av analysedesign, men vi opplever fortsatt tilfeller av interferens i analysemetodene.
På grunn av krav til kort svartid og store prøvemengder er det ikke mulig, rutinemessig, å vurdere hvert enkelt analyseresultat, eller se det opp mot tidligere prøvesvar fra pasienten. Vi benytter oss av regler i laboratoriedatasystemet som gjør at analyseresultater som avviker, blir stoppet for teknisk eller medisinsk vurdering, men vi ønsker ikke å ha for mange slike regler. Vi er derfor avhengig av at rekvirenter som stusser på at prøveresultater ikke stemmer med pasientens klinikk, tar kontakt med oss. Ved mistanke om at et prøveresultat er feil, må vi bruke kunnskapen vår til å søke etter mulig årsak og gjøre tiltak når det er mulig.
I denne artikkelen vil jeg belyse ulike typer interferens og dele noen eksempler fra vår laboratoriehverdag.
Kilder til interferens i immunologiske analysemetoder
HIL – Hemolyse, ikterus, lipemi
Serumindeks for hemolyse, ikterus og lipemi (HIL), gir viktig informasjon om mulig interferens i flere typer analysemetoder. For de fleste av våre analysemetoder er grenseverdiene for HIL oppgitt i pakningsvedlegget. På vår automasjonsløsning har vi ingen visuell vurdering av prøvene og måler derfor HIL i alle prøver der det har betydning for analysen. Vi lager regler som stopper resultater, dersom HIL verdiene er så høye at de kan medføre interferens i analysen.
Matrikseffekter
Biologiske prosesser i pasienten, grunnet ulike sykdommer, kan påvirke blodet slik at den normale sammensetningen forstyrres. Det kan være forandringer i struktur på proteiner og peptider, eller utskillelse av stoffer som normalt ikke forekommer i blodet. Dette gjelder for eksempel hos pasienter som får dialysebehandling, plasmaferese eller har komplementaktivering, hvor blodprøven kan ha en så endret viskositet og sammensetning at den vil oppføre seg annerledes i analysen. Ytre påvirkning som fryse/tine-sykluser eller oppbevaring ved feil temperatur kan også endre matriks.
Vi snakker også om matrikseffekt i kontrollmaterialer. Ved produksjon av store porsjoner kontrollmateriale kan de bli manipulert ved å tilsette stoffer for økt stabilitet og for å ligne pasientserum. Oppkonsentrering, fortynning, eller frysetørring kan også gjøre at kontrollmaterialet oppfører seg ulikt, analysert med ulike analysemetoder. Det er viktig å være klar over ved kjøp av kommersielle kontrollmaterialer til bruk i rutine, eller ved deltakelse i sammenlignende laboratorieprøvinger (SLP) (1).
Kryssreaktivitet
Kryssreaktivitet forekommer som regel fordi prøven inneholder forbindelser som har liknende strukturelle egenskaper, og dette kan for eksempel forekomme med hormoner. Kjønnshormonet human chorionic gonadotropin (HCG) ligner kjemisk på tyreoideastimulerende hormon (TSH), luteiniserende hormon (LH) og follikkelstimulerende hormon (FSH). Ved lignende molekylære strukturer er det en mulighet for at disse kan kryssreagere i analysen, og gi feil analyseresultat.
Kryssreaktivitet kan også forekomme ved behandling med medikamenter som har strukturlikheter med hormonet man skal måle. Et eksempel er behandling av brystkreft med østrogenreseptorantagonisten fulvestrant. Dette virkestoffet ligner på østradiol og kan gi kryssreaksjon i analysen og feil analyseresultat (2).
I infeksjonsimmunologi er det flere muligheter for kryssreaktivitet. Dette opptrer som regel tidlig i infeksjonsforløp, med høy konsentrasjon av IgM-antistoff, som basert på størrelse og struktur kan gi kryssreaktivitet. Epstein Barr virus (EBV)-infeksjon kan føre til positiv cytomegalovirus (CMV)-IgM på grunn av polyklonal stimulering av B-celler, og CMV-antistoffer kan kryssreagere i IgM-tester for EBV (3).
For allergianalyser er det stor grad av kryssreaksjon, men det er godt kjent og dokumentert, og også med på å gi et helhetsbilde ved allergidiagnostikk. Pasienter som er allergiske har lett for å være allergisk overfor flere allergener. Ulike pasienter reagerer og danner antistoffer mot forskjellige deler av proteinet. Kryssreaktivitet i analysen kan skyldes reell symptomgivende kryssreaktivitet hos pasienten, men det kan også være uten klinisk betydning.
Heterofile antistoffer
Heterofile antistoffer er humane antistoffer rettet mot antistoffer fra dyr. Som regel er det IgM antistoff, og det er ikke kjent hvorfor noen danner heterofile antistoffer eller om disse har en funksjon i immunforsvaret. Noen har heterofile antistoffer i en periode, mens andre ser ut til å ha dem permanent.
Man tenker seg at heterofile antistoffer kan oppstå etter eksponering for terapeutiske eller diagnostiske museantistoffer (HAMA) eller behandling med biologiske medikamenter (Mab). Det antas også dannet etter nærkontakt med dyr, eller opphold i miljø med ekskrementer fra for eksempel mus. Heterofile antistoffer binder seg lett til andre antistoffer og kan derfor gi problemer med interferens i immunologiske analysemetoder (2, 4) (figur 1).
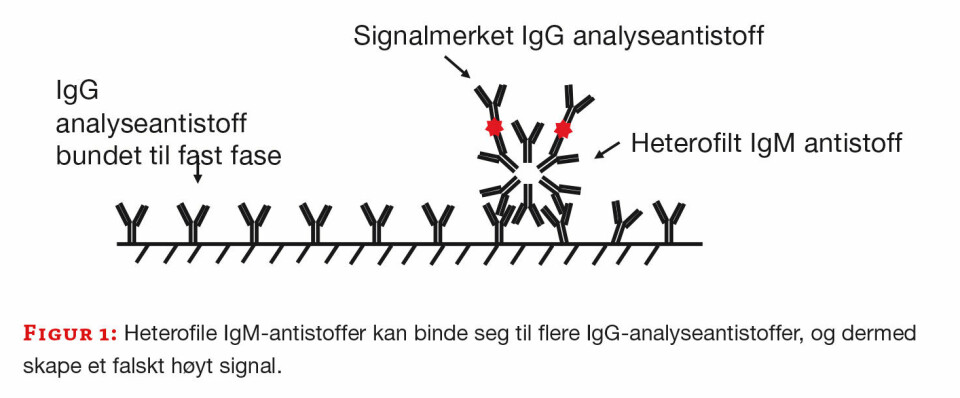
Reumatoide faktorer (RF) er humane antistoffer rettet mot humane antistoffer. RF er polyklonale autoantistoffer som binder seg til Fc-fragmentet på IgG-molekyler. De er oftest av type IgM, men det kan også være IgG eller IgA. Noen RF-antistoffer reagerer med dyreantistoffer og vil derfor også kunne være heterofile antistoffer og være årsak til interferens (2).
Makroprolaktin
Prolaktin er et hormon som skilles ut fra hypofysen, og stimulerer blant annet til vekst og modning av de melkeproduserende kjertlene i brystvev. Hormonet kan forekomme i forskjellige molekylære former, blant annet som såkalt ”big-big”-prolaktin (makroprolaktin) (5). Dette er et kompleks av prolaktin og bindeprotein, oftest IgG, som antas å ha liten eller ingen biologisk aktivitet. Ulike prolaktinanalyser medbestemmer makroprolaktin i ulik grad, og analysen vi benytter medbestemmer i liten grad makroprolaktin. I alle førstegangsprøver med prolaktinkonsentrasjoner over 800 mIE/L vil det likevel bli utført felling med polyetylenglykol (PEG) for å undersøke mulig tilstedeværelse av makroprolaktin.
Biotin og streptavidin
Biotin og streptavidin benyttes ofte i immunologiske analyseprinsipper for å forsterke signalet og øke følsomheten i deteksjonstrinnet. Bindingen mellom dem er en av de sterkeste ikke-kovalente bindingene som finnes. Man kan for eksempel ha paramagnetiske mikropartikler dekket av streptavidin, og biotinylerte antistoffer.
Biotin er et biologisk aktivt vitamin (B7/B8) som deltar i energiomsetningen av fett og karbohydrater. Det markedsføres som et vidundermiddel for hår og negler i skjønnhetsindustrien, og kan kjøpes på nett og i utlandet, i svært høye konsentrasjoner. I tillegg er svært høye doser av biotin er foreslått å ha positiv effekt i behandling av multippel sklerose (MS) (6). Biotinpreparater med lavere konsentrasjoner er også å finne på apoteket, og brukes til behandling av biotinasemangel hos nyfødte eller til pasienter med ernæringsutfordringer.
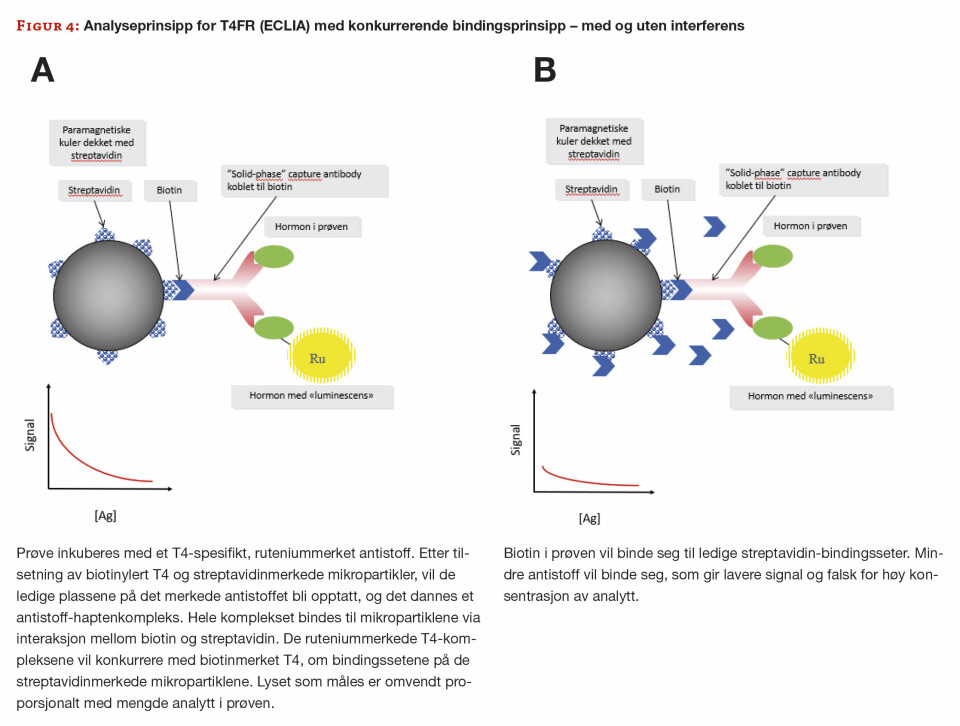
Tilskudd av biotin vil kunne medføre falsk for høye, eller for lave resultater, avhengig av om det er et kompetitivt eller ikke-kompetitivt bindingsprinsipp i analysen. Biotinet i prøven vil konkurrere med de biotinylerte antistoffene om bindingssetene på mikropartiklene (7).
Streptavidin produseres av bakterien Streptomyces avidinii, og funksjonen er trolig å hemme vekst av konkurrerende bakterier. Noen personer danner uspesifikke IgG- og IgM-antistoffer mot Streptavidin, av ukjent årsak. Mekanismen for denne typen interferens er at de uspesifikke antistoffene mot Streptavidin maskerer Streptavidin på mikropartiklene, slik at biotinylert antistoff ikke kan binde seg.
Monoklonal komponent
Hos noen kan aktivering av plasmaceller gi en overproduksjon av monoklonalt antistoff, og det blir en opphopning av såkalt M-komponent i serum. Dette kan forekomme ved myelomatose, monoklonal gammopati av usikker betydning (MGUS) eller andre lymfoproliferative lidelser (8). M-komponent kan kryssreagere på grunn av strukturlikhet med antistoffer i analysen, og kan også påvirke viskositeten i serumet og gi matrikseffekter (5).
Kasuistikker
Kasus 1
Pasienten er en kvinne, født i 1942, som får oppfølging på grunn av atrieflimmer. Som et ledd i videre behandling besluttes det å utføre elektrokonvertering. Pasienten står på behandling med digoksin, som er et digitalisglykosid som benyttes i behandling av blant annet hjertesvikt og atrieflimmer. Digoksin skal seponeres før planlagt elektrokonvertering kan utføres, og legemiddelkonsentrasjonen blir derfor målt. Ved normal nyrefunksjon er halveringstiden for digoksin 1,5 - 2 døgn.
Kvinnen tar den første blodprøven og får beskjed om å avslutte digoksinbehandlingen. Etter en uke er verdien bare halvert. Legen mistenker at hun har tatt medisin likevel. Det blir tatt flere prøver uten at verdien går ned, og legen er nå sikker på at pasienten ikke tar digoksin (tabell 1). Laboratoriet blir kontaktet med beskjed om at det mistenkes å være noe feil i analysen.
Serum fra pasienten ble sendt til leverandørens testlaboratorium for utvidede undersøkelser:
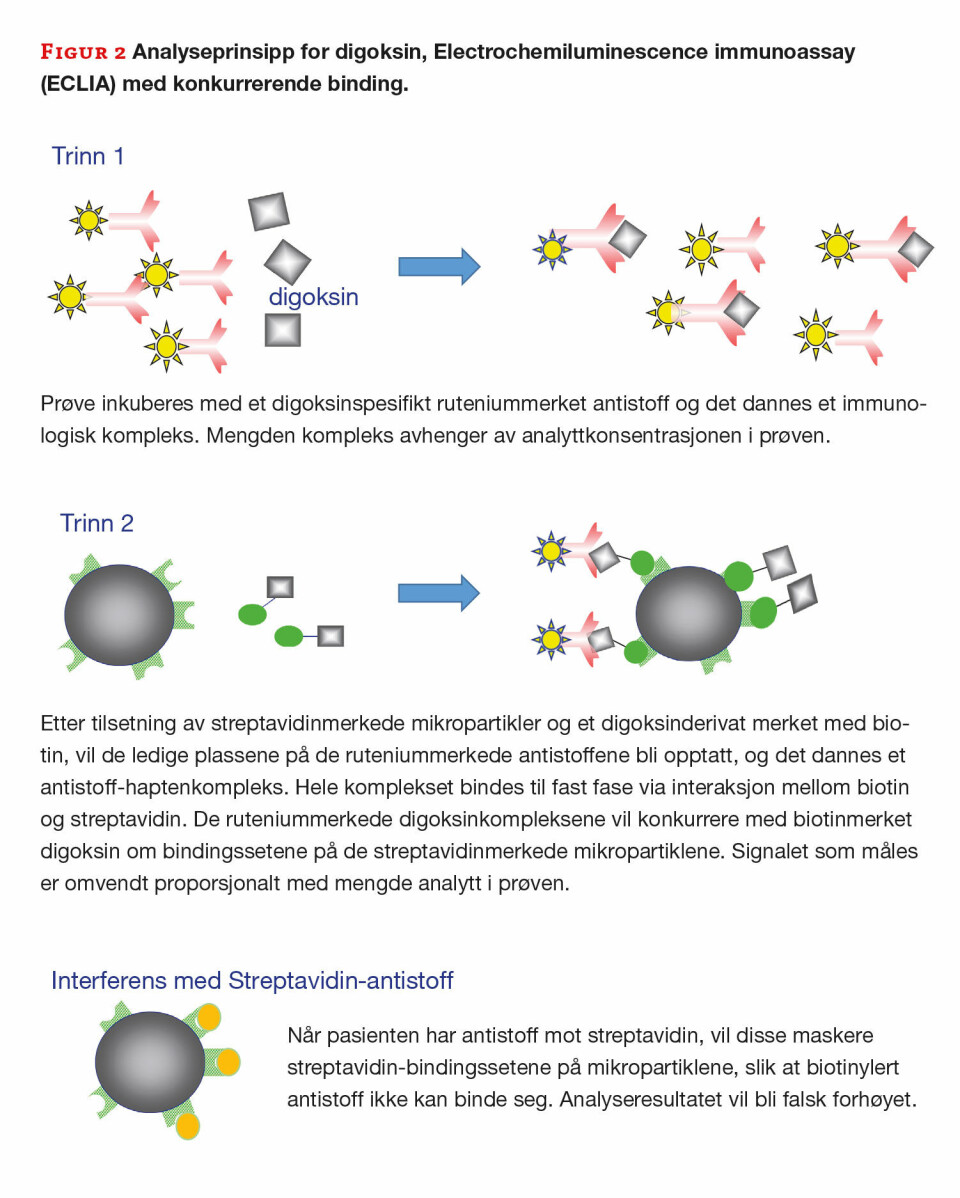
Originalprøven ble analysert i testlaboratoriet og resultatet ble bekreftet. Prøven ble deretter fortynnet 1:5 og reanalysert med fortsatt forhøyet resultat. Fortynnet prøve ble deretter forbehandlet på ulike måter. Tre prøver ble behandlet med antistoff som inngår i analysen, en prøve ble behandlet med streptavidinmerkede mikropartikler (SA kuler) og en prøve ble behandlet med umerkede mikropartikler.
Det var bare prøven som var forbehandlet med SA kuler som ble negativ, og dette bekrefter at pasienten hadde antistoffer mot streptavidin som ble bundet opp av kulene. Siden dette er et kompetetivt immunoassay, hvor luminescens-signalet er omvendt proporsjonalt med konsentrasjonen, vil det bli lavere signal og falsk for høy konsentrasjon fordi streptavidin-antistoffer maskerer bindingssetet for biotin (figur 2).
Kasus 2
En kvinne født i 1974 gikk til oppfølging på nevrologisk avdeling, hvor det ved hver konsultasjon blant annet ble målt tyreoideastimulerende hormon (TSH) og fritt tyroksin (T4FR). Hun har normal TSH og T4FR i februar 2018. Det tas utvidede tyreoideaprøver samt Vitamin D i begynnelsen av september 2018. Alle prøveresultatene er patologiske og viser svært hypertyreoide verdier som passer med Graves sykdom, i tillegg til at Vitamin D er over toksisk grense (tabell 2).
Analyseresultatene stemmer ikke med klinikk hos pasienten, og legen rekvirerer nye prøver. Resultatene fra midten av september 2018 er enda mer ekstreme (tabell 2) og vi forstår at det må være noe feil i våre analyser. Prøvene blir videresendt til et annet laboratorium som benytter en analysemetode fra en annen leverandør. Her er prøvesvarene helt normale.
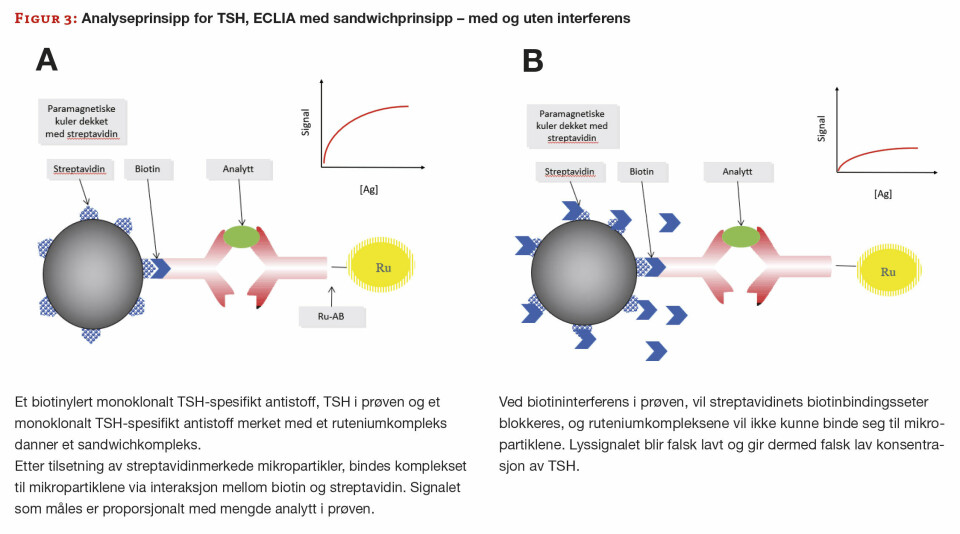
Det viser seg at pasienten har MS, og vi får derfor mistanke om biotininterferens. Vi ber legen undersøke med pasienten, og det viser seg at hun via internett har funnet råd om bruk av biotin i behandling av MS, og har kjøpt dette utenlands. Hun har tatt høye doser biotin, som forklarer de svært unormale resultatene. Analyseprinsippene for alle tyroidea-parameterene, samt vitamin D, er biotin-baserte. TSH benytter ikke-kompetitiv sandwich-teknikk og de resterende benytter et kompetitivt analyseprinsipp (figur 3 og 4).
Pasienter som tar høye biotindoser, bør i henhold til reagensleverandørenes anbefaling, vente minst 8 timer etter inntak, før prøvetaking.
Tiltak ved mistanke om interferens i analysen
Ved mistanke om feil prøvesvar, vil man i første omgang reanalysere prøven og deretter eventuelt fortynne prøven, for å se om utslag av interferens blir mindre.
Videre tiltak vil være avhengig av type analyse og aktuell form for interferens.
Ved spørsmål om makroprolaktin utføres felling med PEG, rutinemessig.
Dersom man har tilgang på blokkeringsreagens, IgG antistoff fra mus, kan dette tilsettes prøven for å blokkere/binde heterofile antistoffer før reanalyse. Hensikten vil i så fall være å dokumentere sannsynlig interferens (9).
Enkelte analyser kan utføres med LC/MS (væskekromatografi med massespektrometer), hvor interfererende stoff vil kunne skilles fra analytten.
Generelt er et godt tips å ha oversikt over hvilke analysemetoder som benyttes på andre laboratorier, slik at man kan videresende prøven for analyse med en annen analysemetode.
Hvis man blir kjent med en type interferens er det viktig å informere rekvirenten slik at vedkommende kan gi pasienten beskjed om forholdsregler i forkant av neste prøvetaking, der det er aktuelt.
Det er svært viktig å melde inn mistanke om interferens til leverandør/produsent av analysen. Leverandør har ofte et større apparat for utvidet testing slik at interferens kan bli påvist og konkludert. Dersom flere melder fra om samme problem vil produsenten se behovet for videreutvikling og forbedring av analysen.
Oppsummering
Interferens i analyser er ikke et hyppig problem, men vi må likevel være bevisst på at det forekommer, uavhengig av leverandørens dokumentasjon. Bevissthet rundt økt bruk av biologiske legemidler i for eksempel behandling av kreft, alvorlige betennelsessykdommer og sannsynligvis flere indikasjoner i fremtiden, er viktig.
Reagensprodusentene må jobbe kontinuerlig for å forbedre reagensene og blokkere for antistoffinterferens. Flere analyser kommer nå med produktoppdateringer, der terskelverdi for biotin er økt betraktelig. I tillegg har noen av analysene fått et bedre streptavidin-blokkerende protein, som gjør dem mindre utsatt for streptavidininterferens.
Det er en fordel at ikke alle laboratorier har samme analysemetoder, slik at man har mulighet til å kontrollere resultater med en annen metode.
Et godt samarbeid mellom klinikere og bioingeniører og leger i laboratoriene er viktig, slik at de i større grad er i stand til å vurdere prøvesvar på sine pasienter. Vi er i mange tilfeller avhengige av at klinikerne gir tilbakemelding om uventede resultater slik at vi kan starte jakten på mulig interferens!
Takk
Jeg vil takke avdelingsoverlege Gunnhild Kravdal for lån av tabeller og enkelte figurer.
Referanser
1. NOKLUS generelle kommentarer til utsendelsene; labquality Hormoner A; Letter 42-02007-062019.pdf
2. Bolstad N, Nustad K. Interferens fra heterofile antistoffer i immunometriske analyser. Bioingeniøren. 2012;6/7:16-22.
3. Folkehelseinstituttet. Strategimøte 2016: Kvalitetskontroll av infeksjonsserologiske metoder: https://www.fhi.no/publ/strategimoter/strategimote-2016-kvalitetskontroll-av-infeksjonsserologiske-metoder/ (31.08.2019).
4. Bjerner J, Nustad K. Heterofile antistoffer – en kilde til analyseinterferens. Norsk Epidemiologi 2006;16 (1):29-33.
5. Nasjonal brukerhåndbok i medisinsk biokjemi. Prolaktin: http://brukerhandboken.no/index.php?action=showtopic&topic=8dc3209ad2b1e085d9ab (20.11.2019).
6. Folkehelseinstituttet. Biotin (Qizenda) til behandling av primær og sekundær progressiv multippel sklerose (PPMS og SPMS): https://www.helsebiblioteket.no/mednytt/legemidler/biotin-qizenda-til-behandling-av-primaer-og-sekundaer-progressiv-multippel-sklerose-ppms-og-spms (31.08.2019).
7. Stender S. Biotin-interferens af laboratorieanalyser. Klinisk Biokemi i Norden. 2018;4:32-4.
8. Nasjonal brukerhåndbok i medisinsk biokjemi. Proteinelektroforese. http://brukerhandboken.no/index.php?action=showtopic&topic=6185e620c2314e4dc312 (20.11.2019).
9. Bolstad N, Warren DJ, Bjerner J, Kravdal G, Schwettmann L, Olsen KH, et al. Heterophilic antibody interference in commercial immunoassays; a screening study using paired native and pre-blocked sera. Clin Chem Lab Med. 2011;49(12):2001-6.
























