FAG i praksis
Kasuistikk: En mann med depresjon og mangelfull effekt av venlafaksin
En mann i 40-årene med depresjon ble oppfattet som terapiresistent, og det ble byttet medikasjon flere ganger. Til sist ble han behandlet med venlafaksin, med usikker klinisk effekt. Ved hjelp av serumkonsentrasjonsmålinger av venlafaksin kunne man etter hvert avdekke den sannsynlige årsaken til den mangelfulle effekten.
Av GRETE SÆTHER (1), bioingeniør, kvalitetskoordinator; ROAR DYRKORN (1) overlege; OLAV SPIGSET (1,2), overlege, professor; KETIL ARNE ESPNES (1), overlege
1) Avdeling for klinisk farmakologi, St. Olavs hospital
2) Institutt for klinisk og molekylær medisin, Norges teknisk-naturvitenskapelige universitet
E-post: ketil.espnes@stolav.no
En mann med depresjon og mangelfull effekt av vanlafaksin.pdf(274 KB)
Venlafaksin er i Norge godkjent for behandling av depresjonslidelser og angstlidelser (inklusive generalisert angst, sosial angst og panikkangst).
Medikamentet hemmer reopptak av serotonin og noradrenalin til presynaptisk nevron og fører dermed til at mer nevrotransmitter blir tilgjengelig i synapsespalten. Venlafaksin er en mindre potent serotoninreopptakshemmer enn selektive serotoninreopptakshemmere (SSRI).
Vi presenterer en pasientkasuistikk med en serie serumkonsentrasjonsmålinger av venlafaksin, der målingene kunne bidra til at rekvirerende kliniker fikk en bedre forståelse for årsaken til pasientens manglende effekt av forskrevet legemiddel. I tillegg fikk rekvirenten innsikt i hvordan serumkonsentrasjonsmålinger kan bidra til å oppklare eventuelle genetiske varianter og/eller legemiddelinteraksjoner når serumkonsentrasjonene som måles er avvikende fra standarden.
Manglende effekt av behandling
En mann i 40-årene med diagnosen depresjon ble behandlet i psykiatrisk poliklinikk. Han ble oppfattet som terapiresistent, og det ble byttet legemiddel flere ganger. Den siste tiden hadde man trappet opp dosen på venlafaksin depottabletter til nåværende dosering 450 mg/d. Fortsatt var det ingen sikker effekt. Han brukte ingen andre legemidler. Siden dosen av venlafaksin var over anbefalt maksimaldose på 375 mg/d, ønsket legen å foreta en serumkonsentrasjonsmåling.
Første prøve ble tatt kl. 08.45, og pasienten oppga å ha tatt siste dose på 450 mg på morgenen dagen før, altså ca. 24 timer før prøvetaking. Prøvesvaret viste en serumkonsentrasjon på 0 nmol/l; verken venlafaksin eller den aktive metabolitten O-desmetylvenlafaksin (ODMV) ble påvist. Referanseområdet for summen av venlafaksin og ODMV er 400-2000 nmol/l ved prøver tatt 12-24 timer etter siste tablettinntak.
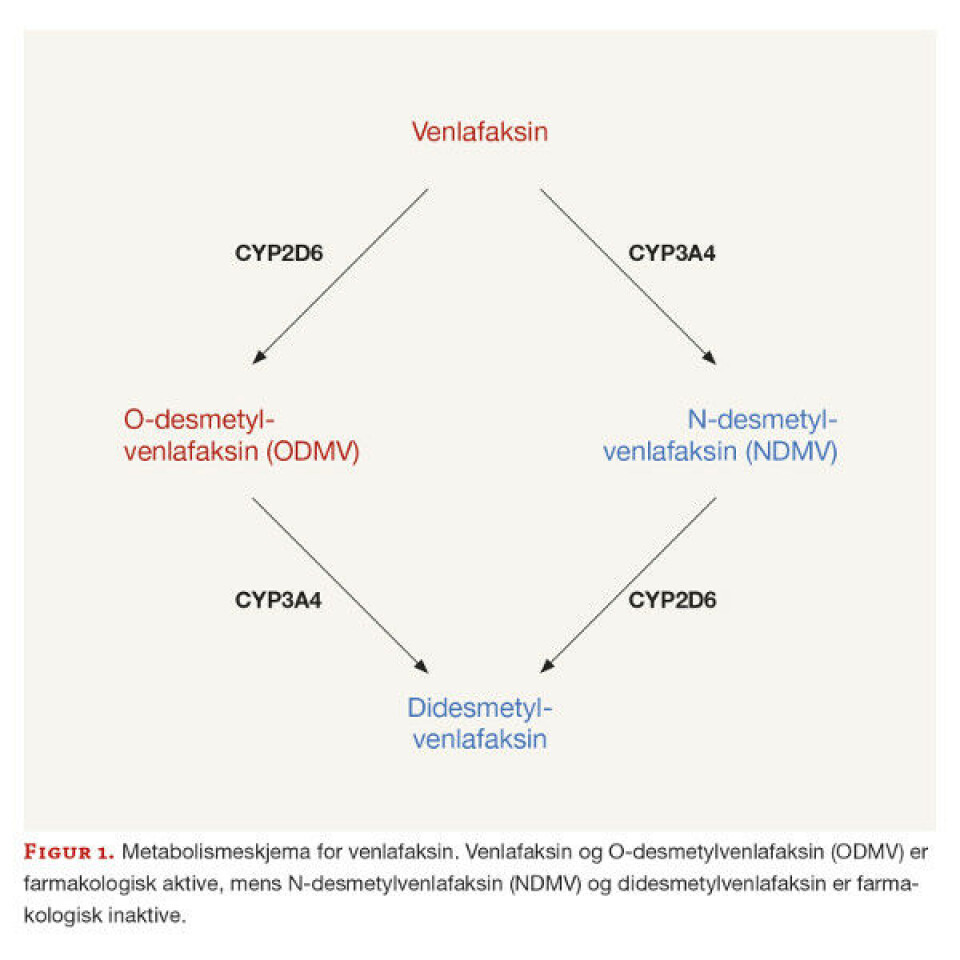
Venlafaksin omsettes i leveren hovedsakelig til to metabolitter (figur 1), via enzymet cytokrom P-450 (CYP) 2D6 til den farmakologisk aktive metabolitten ODMV og via enzymet CYP3A4 til den inaktive metabolitten N-desmetylvenlafaksin (NDMV) (1). Begge metabolittene omsettes videre til didesmetylvenlafaksin, som i hovedgrad skilles ut i nyrene. ODMV bidrar vanligvis i stor grad til den farmakologiske effekten, da det gjerne er flere ganger så høy konsentrasjon av ODMV som av venlafaksin i plasma (2).
Mulige årsaker
Hva kan det så skyldes at det ikke ble påvist venlafaksin hos vår pasient? Noen mulige alternativer er:
- Pasienten har ikke inntatt medisinen som forutsatt.
- Pasienten har en genetisk variant som medfører svært rask omsetting av venlafaksin via CYP2D6 i leveren.
- Pasienten har inntatt et annet (lege-)middel som ved interaksjon øker metabolismen av venlafaksin via CYP3A4.
- Pasienten har en tilstand som medfører at venlafaksin ikke absorberes fra tarmen.
Hvis pasienten genetisk sett er en ultrarask omsetter via CYP2D6, slik som 2-5 % i etnisk norsk befolkning, vil venlafaksin omsettes svært raskt til ODMV (3). Da vil imidlertid konsentrasjonen av ODMV bli høyere enn vanlig, og ikke som i dette tilfellet, ikke målbar. Selv om det ikke er påvist genetiske varianter som gir ekstra rask metabolisme via CYP3A4, er det stor interindividuell variasjon i metabolsk hastighet også for dette enzymet (3). I tillegg kan flere legemidler øke aktiviteten til CYP3A4 kraftig, for eksempel karbamazepin, fenobarbital, fenytoin og rifampicin (3,4).
Det plantebaserte legemidlet johannesurt, som brukes ved nedstemthet, er også en kraftig induktor av CYP3A4 (3,4). I teorien kan det derfor tenkes at pasienten kan omsette legemidler også via CYP3A4 med svært høy hastighet. Men, det at en kombinasjon av genetikk og interaksjon(er) skal medføre svært rask metabolisme både via CYP2D6 og CYP3A4 samtidig er svært usannsynlig, og det er enda mer usannsynlig at denne effekten skulle være så kraftig at det ikke finnes målbare konsentrasjoner verken av venlafaksin eller ODMV (3,4), spesielt siden pasienten ble behandlet med en høy venlafaksindose, 450 mg per døgn. Det er ikke kjent at det eksisterer tilstander som hindrer absorpsjonen av legemidler fra tarmen i så stor grad at de ikke vil bli absorbert i det hele tatt, så denne muligheten kan man også se bort fra.
Legens arbeidshypotese blir derfor at pasienten mest sannsynlig ikke har inntatt venlafaksin. Legen har en samtale med pasienten der de diskuterer analyseresultatet. Det fremkommer at pasienten har inntatt venlafaksin uregelmessig. De blir enige om at han skal fortsette med samme dose, ta tablettene mer regelmessig i fremtiden, og ta en ny serumkonsentrasjonsmåling ved neste kontroll om en måneds tid.
Prøvetaking til riktig tidspunkt?
Når neste prøve tas en måned senere, angir pasienten at han ikke har tatt dagens dose. Han husker ikke sikkert om han tok tablettene dagen før, men han er helt sikker på at han tok 450 mg på ettermiddagen to dager før, dvs. ca. 42 timer før prøvetaking. Denne gangen måles serumkonsentrasjonen av venlafaksin til 14 nmol/l og serumkonsentrasjonen av ODMV til 716 nmol/l, til sammen 730 nmol/l.
Kan denne konsentrasjonen være forenlig med at pasienten glemte å ta dosen dagen før, men har tatt tablettene tidligere?
Det anbefales (med noen få unntak) at prøver til serumkonsentrasjonsmålinger tas medikamentfastende, dvs. like før neste legemiddeldose skal inntas. For venlafaksin depottabletter vil dette som oftest være 24 timer etter siste inntak. Hvis prøven skal tas på legekontoret eller på avdelingen på formiddagen, er det derfor viktig at pasienten utsetter dagens dose til etter at prøven er tatt.
Det er den medikamentfastende konsentrasjonen som skal ses i relasjon til referanseområdet. Hos denne pasienten ville konsentrasjonen 24 timer etter inntak vært en del høyere enn den målte konsentrasjonen, fordi prøven ble tatt 42 timer etter inntak. Men er det mulig å si noe om hvor mye høyere den ville ha vært?
Venlafaksin har en gjennomsnittlig halveringstid på 5-6 timer, mens halveringstiden for ODMV er ca. 12 timer (5). Når pasienten bruker depottabletter vil absorpsjonen av medikamentet fra tarmkanalen forsinkes, slik at det frem til 8-10 timer etter inntak vil frigjøres legemiddel fra depottabletten i tarmen. Det betyr at man først 8-10 timer etter inntak kan begynne å regne med konsentrasjonsreduksjoner som svarer til halveringstiden.
Forutsatt at pasienten i det aktuelle tilfellet tok siste dose 42 timer før prøvetaking, er tidspunktet for anbefalt prøvetaking passert med 18 timer. Dette tilsvarer rundt regnet tre halveringstider for venlafaksin. Ved å regne tilbake finner en at en konsentrasjon på 14 nmol/l 42 timer etter siste inntak, tilsvarer 14 nmol/l × 23 = 112 nmol/l hvis prøven hadde vært tatt 24 timer etter siste inntak.
For ODMV vil et tilsvarende regnestykke kompliseres av at denne metabolitten hele tiden produseres fra venlafaksin. Hvis man likevel tillater seg å regne tilbake, er utgangspunktet at det har gått 1,5 halveringstider for ODMV. Da vil en konsentrasjon på 716 nmol/l 42 timer etter siste inntak tilsvare knappe 2000 nmol/l dersom prøven hadde vært tatt 24 timer etter siste inntak. Vi kan derfor estimere at 24 timer etter inntak, ville summen vært ca. 2100 nmol/l.
Spørsmålet blir da: Er denne konsentrasjonen rimelig sett i forhold til pasientens dose?
Den gjennomsnittlige konsentrasjon/dose (C/D)-ratioen for venlafaksin er 5,3 (2), det vil si at en dose på 450 mg/d i gjennomsnitt vil gi en 24 timers konsentrasjon på 2385 nmol/l (for summen av venlafaksin og ODMV). Pasientens estimerte konsentrasjon tilsvarer en C/D-ratio på ca. 4,7, og stemmer svært bra med dette.
Konklusjonen er at den målte konsentrasjonen er forenlig med at prøven ble tatt 42 timer etter siste inntak, og forutsatt at opplysningene om inntak stemmer, er det ingenting som tyder på noen form for avvik i metabolsk kapasitet hos denne pasienten. Siden halveringstidene for de to stoffene er relativt korte, er det ikke mulig å si noe om hvor regelmessig inntaket har vært før dette.
Laboratoriet presiserer at denne formen for tilbakeregning er usikker, særlig når de aktuelle substansenes halveringstider er korte. Det er uansett viktig at laboratoriet alltid får opplyst størrelsen på doseringen, når siste dose ble inntatt, når prøvetakingen skjedde og hvilke andre legemidler pasienten tar. Etter doseendringer bør det gå minst fem halveringstider før ny serumkonsentrasjonsmåling foretas, slik at man er sikker på at ny likevekt er oppnådd.
Ny kontroll ved forverring
Pasienten svinger i sin psykiske helsetilstand, og noen måneder senere blir han så mye dårligere at han blir innlagt i psykiatrisk avdeling. Medisineringen med venlafaksin depottabletter 450 mg i døgnet fortsetter uforandret. Etter en uke i sykehuset ønsker behandlende lege en ny serumkonsentrasjonsmåling, og denne blir tatt kl. 08.15. Siste dose med 450 mg venlafaksin var inntatt kl. 08 dagen før, dvs. ca. 24 timer tidligere. Serumkonsentrasjonen denne gang er 412 nmol/l for venlafaksin og 1547 nmol/l for ODMV, til sammen 1959 nmol/l.
Ut fra dette blir C/D-ratio beregnet til 4,4. Dette er godt innenfor det forventede hos en person som ikke har genetiske avvik eller interaksjoner med andre legemidler, og stemmer også bra med den forrige verdien på 4,7.
Forholdet mellom morsubstans og aktiv metabolitt er 1:4, noe som er helt vanlig hos pasienter som verken har genetisk variant i sitt CYP2D6 eller bruker legemidler som hemmer aktiviteten til CYP2D6. Ved ultrarask metabolisme via CYP2D6 vil forholdet i regelen være mindre enn 1:10, og ved langsom metabolisme via CYP2D6 vil det være større enn 1:1 (1,6,7).
Alt dette tyder på at pasientens informasjon har vært korrekt. Han har nå tatt sine tabletter som forskrevet, men har tross dette blitt sykere av sin depresjon.
Diskusjon
Det er mange mulige forklaringer på «avvikende» serumkonsentrasjoner, i vårt tilfelle ender vi opp med manglende eller uregelmessig legemiddelinntak som den mest sannsynlige forklaringen. Hvis dette har vært den gjennomgående årsaken også til «terapiresistens» på andre legemidler, så kunne problemet kanskje vært avdekket med en serumkonsentrasjonsmåling på et tidligere tidspunkt.
Man må likevel være oppmerksom på muligheten for genetiske variasjoner i metabolismen for enkelte legemidler, og likeledes muligheten for at metabolismen påvirkes ved interaksjoner med andre legemidler pasienten bruker. Hvis det er vedvarende avvik i serumkonsentrasjoner for legemidler, kan farmakogenetisk analyse av CYP-enzymer være indisert før man eventuelt velger et annet legemiddel. Hvis man er i tvil kan det være hensiktsmessig å konsultere en klinisk farmakologisk avdeling før rekvirering.
Kasuistikken viser klart at det diagnostiske og behandlingsmessige utbyttet av serumkonsentrasjonsmålinger av legemidler blir best når de anbefalte forholdene i forbindelse med prøvetaking overholdes. Det vil for de aller fleste legemidler si at prøven skal tas medikamentfastende, rett før neste dose skal inntas. I tillegg er det viktig at ny prøve etter oppstart eller doseendring ikke blir tatt før det har gått fem halveringstider for det legemiddelet og ev. aktive metabolitter siden det er den tiden det tar før likevektskonsentrasjon har innstilt seg på aktuell dosering.
Pasienten har gitt samtykke til at artikkelen blir publisert.
























