FAG resymé
Komplementfaktor C3b er viktig for Escherichia coli-indusert trombocyttaggregering
Trombocyttene er viktige aktører i mange ulike sykdommer og har roller innenfor både koagulasjon og immunforsvar. Vi ønsket å kartlegge mer av samspillet mellom komplementsystemet, en del av immunforsvaret, og Escherichia coli (E. coli)-indusert trombocyttaggregering.
Av ANNE LANDSEM og OLE-LARS BREKKE
Trombocyttene er viktige aktører i mange ulike sykdommer og har roller innenfor både koagulasjon og immunforsvar. Vi ønsket å kartlegge mer av samspillet mellom komplementsystemet, en del av immunforsvaret, og Escherichia coli (E. coli)-indusert trombocyttaggregering.
Studien ble utført ved Nordlandssykehuset i Bodø og ved Linnéuniversitet i Kalmar (Sverige). Artikkelen ble publisert i Frontiers in Immunology i desember 2022 (1).
Bakgrunn
Trombocyttene er sentrale i dannelsen av tromboser ved akutt inflammasjon. Samspillet mellom de ulike kaskadesystem, som koagulasjon og immunforsvaret, kalles tromboinflammasjon og aktiveres ved en rekke sykdommer.
Økt forståelse for dette er nødvendig for å kunne tilby pasientene bedre behandling. Trombocyttene vil komme i kontakt med bakterier ved for eksempel sepsis. Aktiverte trombocytter øker kroppens forsvar mot bakterier ved blant annet å trigge NET-dannelse (neutrophil extracellular traps), utskille antimikrobielle substanser, begrense spredning av bakterier og forhindre invasjon i vevet.
Men økt trombedannelse kan også utgjøre en risiko for pasienten, og føre til disseminert intravaskulær koagulasjon og organsvikt. Medikamenter for å hemme deler av komplementsystemet kan være aktuelle som tilleggsbehandling ved sepsis. Det har tidligere vært vist at komplementfaktor C3a gir økt adenosindifosfat (ADP)-indusert trombocyttaggregering. Vi ville undersøke om dette også var tilfelle for bakterieindusert trombocyttaggregering.
Metoder
I eksperimentene ble det benyttet en etablert fullblodsmodell (2) med blod fra friske givere, hvor alle blodcellene og plasmaproteinene er til stede. Fosfatbuffer (PBS) eller hemmere og lepirudin-antikoagulert fullblod preinkuberes i polypropylenrør før PBS eller aktivatorer tilsettes og inkuberes ved 37°C i ønsket tid, avhengig av analytt. Denne metoden er mer fysiologisk relevant enn andre modeller med isolerte trombocytter eller platerikt plasma (PRP). Ved hjelp av NovoCyte flowcytometer kvantifiserte vi endringer i nivået av trombocyttmarkører, som P-selektin og PAC-1 (det aktive setet av glykoprotein (GP) IIb/IIIa på trombocyttene).
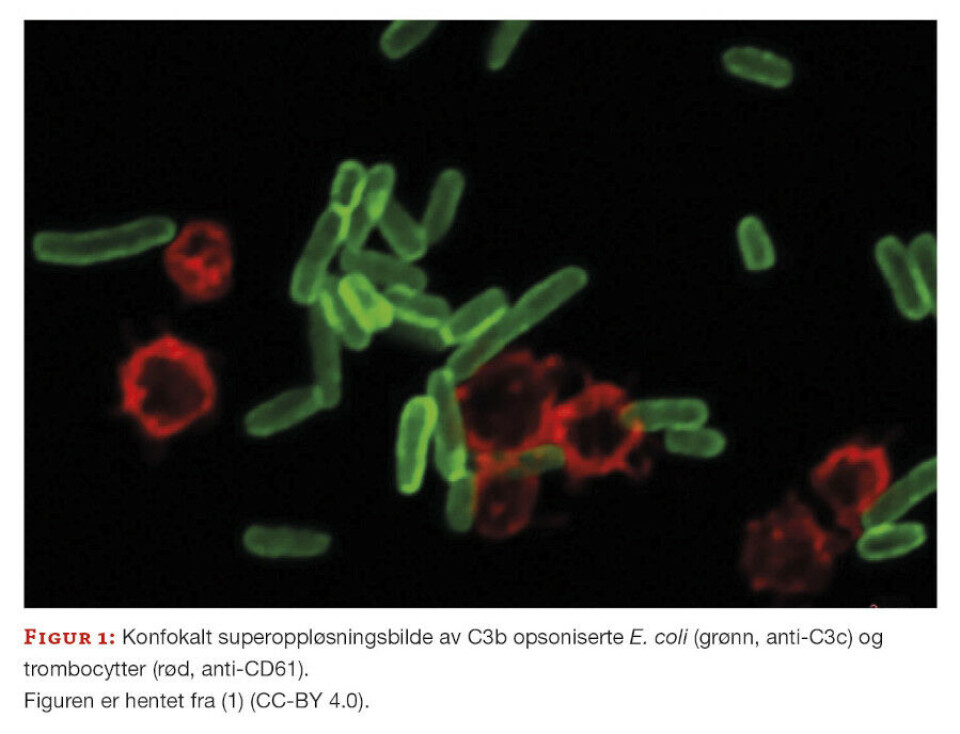
Trombocyttaggregeringen ble målt på et Multiplate® aggregometer i fullblod. Supplerende forsøk ble utført i PRP og med isolerte trombocytter. Det ble laget en «in house»-protokoll med utgangspunkt i fullblodsmodellen og analysetiden ble justert til 30 minutter. En av aktivatorene vi benyttet var varmeinaktiverte E. coli. Både flowcytometri og konfokalt mikroskop (figur 1) ble benyttet for å undersøke om trombocyttene var C3b-opsoniserte.
Resultater
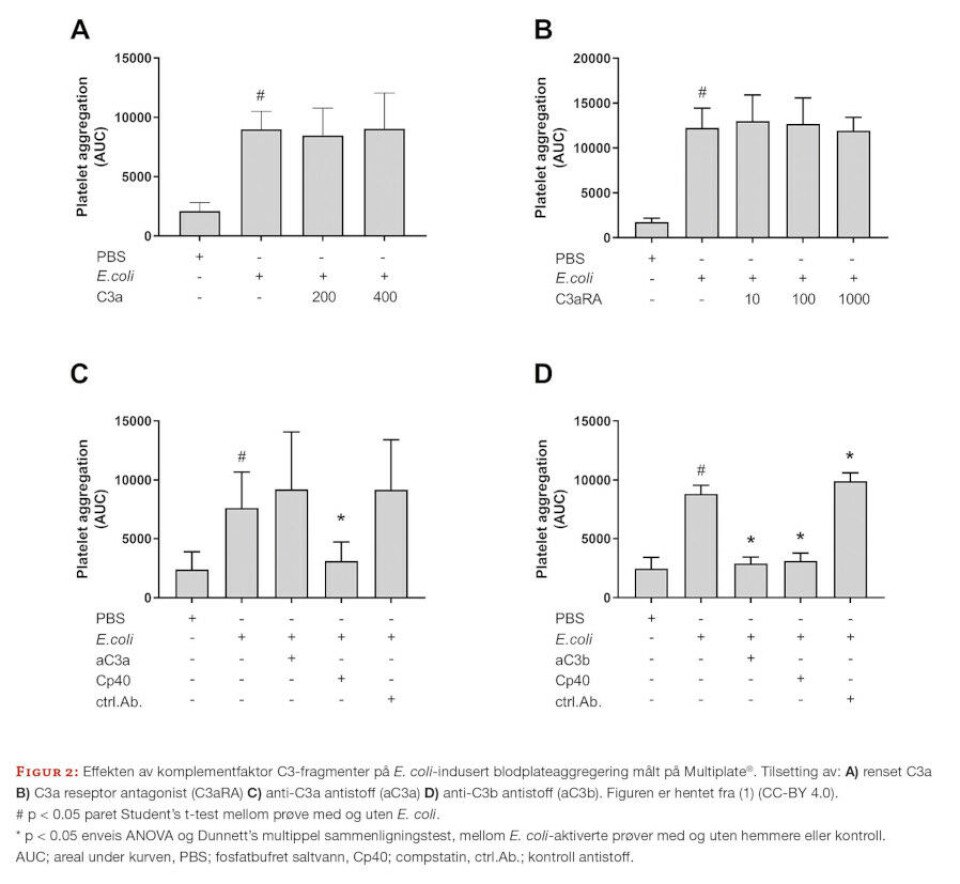
E. coli økte trombocyttaggregeringen hos de aller fleste giverne. Den spesifikke C3 komplementhemmeren compstatin, som hemmer kløyvningen av C3 til C3a og C3b, reduserte økningen i trombocyttaggregering signifikant. Vi fortsatte eksperimentene med ulike strategier for å finne den antatte C3a-avhengigheten.
Vi tilsatte renset C3a, antistoff mot C3a eller C3a reseptor antagonist, men ingen hadde effekt på den E. coli-induserte trombocyttaggregeringen. Vi ville derfor undersøke rollen til C3b og benyttet ett antistoff mot C3b, som hindret C3b-opsonisering. I dette eksperimentet økte E. coli trombocyttaggregeringen fra 2 472 areal under kurven (AUC) til 8 835 AUC (P=0.0047), mens anti-C3b antistoff reduserte den E. coli-induserte trombocyttaggregeringen (fra 8 835 AUC til 2 892 AUC (P=0.0133)) nesten tilbake til nivået i den ikke aktiverte prøven (2 472 AUC) (figur 2).
Vi fant C3b-opsoniserte bakterier, men ingen C3b-opsoniserte trombocytter i våre eksperiment (figur 1).
Videre undersøkelser ble gjort med antistoff mot komplement reseptor 1 (CR1), som binder C3b. Denne reseptoren uttrykkes ikke av trombocytter, men blant annet av erytrocytter. Det ble også benyttet tirofiban, som spesifikt hemmer GPIIb/IIIa-reseptoren. Resultatene viste at begge reseptorene var involvert i E. coli-indusert trombocyttaggregering.
Oppsummering
Resultatene viser at E. coli-indusert trombocyttaggregering er C3b-avhengig, og ikke mediert via C3a, som først antatt. Dessuten er samspillet med andre celler og reseptorene GPIIb/IIIa og CR1 viktig. Dette er viktig kunnskap for å kunne utvikle nye forbedrede adjuvante behandlinger ved sepsis.
























