FAG i praksis
Konservering av blodtypeantigen: ACD- og CPDA-glass er likeverdige
Når blodgiverens erytrocytter skal types eller forlikes med pasientens plasma, brukes erytrocytter fra pilotglass med antikoagulasjonsmidlene ACD eller CPDA. Vi undersøkte om blodtypeantigenene ble svekket når erytrocyttene ble oppbevart i henholdsvis ACD- og CPDA-pilotglass sammenliknet med selve blodposen med SAGMann. Konklusjonen var at forskjellene var få og små og uten klinisk betydning.
Konservering av blodtypeantigen_ACD- og CPDA-glass er likeverdige.pdf(119 KB)
Artikkelen er basert på en bacheloroppgave fra Høgskolen i Oslo og Akershus utført ved Seksjon for immunhematologi, OUS Ullevål.
Innledning
Ved tapping av blodgivere fylles et pilotglass som følger blodposen. Pilotglasset brukes når det er behov for å type erytrocyttene for ulike blodtypeantigener eller det skal gjøres forlik fordi pasienten har fått påvist irregulære blodtypeantistoffer (1). Det er beskrevet 36 blodtypesystemer med totalt over 340 blodtypeantigener (2). I tillegg til ABO-systemet er Rh-, Kell-, MNS-, Duffy- og Kidd-systemene, med antigenene D, c (lille c), K, M, S, Fya og Jka, blant de klinisk viktigste (1). Antistoff mot disse antigenene er som regel av IgG type, og kan forårsake hemolytisk transfusjonsreaksjon (3). Antistoffene kan dessuten vise doseeffekt, det vil si at de kan gi svakere reaksjon mot celler som har antigenet kun på det ene allelet (heterozygote) (3).
I følge litteraturen kan uttrykket av noen blodtypeantigen svekkes under lagring in vitro (4), og dersom dette gir falsk negativ typing eller forlik kan det føre til hemolytisk transfusjonsreaksjon hos pasienten. Blodtypeantigenet bør derfor bevares like godt i pilotglassene som i erytrocyttkonsentratene.
Blodbanken i Oslo har i veldig mange år brukt pilotglass som inneholder antikoagulasjonsmiddelet Acid Citrat Dextrose B (ACD). Holdbarheten til ACD-glass er oppgitt til å være 21 dager ved 1-6 C (5). Erytrocytter til transfusjon lagres i Saltvann Adenin Glukose Mannitol-løsning (SAGMann) som har holdbarhet i 35 dager ved 4 2 C (1). Det finnes et alternativt pilotglass som har holdbarhet i 35 dager ved 1-6 C. Glasset inneholder Citrate Phosphate Dextrose Adenine (CPDA) og ble EC-godkjent i 2000 (5).
Søk etter studier om konservering av blodtypeantigener utenom ABO-systemet i ulike typer pilotglass ga ingen nyere resultater (søkeord: red cell antigen, preservation, anticoagulants, storage, ACD, CPDA, SAGMann). Leverandøren av glassene hadde ikke kjennskap til om det var gjort holdbarhetsstudier for blodtypeantigener i de ulike glassene. Studier fra 1959 og 1964 sammenlignet ACD-glass og glass uten tilsetning (6,7). I disse studiene er det noe uenighet om hvilke blodtypeantigener som svekkes ved lagring, og hvor fort dette eventuelt oppstår. Linins, McIntyre og Moore fant i sin studie fra 1959 at både K- og Fya-antigenene var stabile og ble ubetydelig svekket etter fem uker i ACD, mens c (lille c)-antigenet ga en mye svakere reaksjon etter to uker i ACD når blodtypeantigenet var representert i heterozygot form (6). Sussman og Butler viste i sin studie fra 1964 at Fya-antigenet ga svakere reaksjon med sterke antistoffer etter 26 dagers lagring i ACD, og at K-antigenet ble betydelig svekket etter 23 dager i ACD når man brukte svake blodtypeantistoffer. Studien belyste det urovekkende i at blodtypeantigener lagret i ACD ikke nødvendigvis blir påvist ved forlik med svake immunsera (7). Begge studiene var gjort på få blodgivere og med få antisera.
I denne studien ønsket vi å undersøke om blodtypeantigen ble svekket eller ikke når erytrocyttene ble oppbevart i 35 dager i ACD-glass, CPDA-glass og i selve erytrocyttkonsentratet. Vi ville sammenligne resultatene av typing på utvalgte blodtypeantigener fra noen av de klinisk viktigste blodtypesystemene i de ulike glassene på dag 1 og dag 35. I tillegg ønsket vi å undersøke, ved å gjøre utvidet forlik, om det var forskjeller eller trender når de samme erytrocyttene ble satt opp mot immunantistoff med ulik styrke (titer).
Materialer og metode
Prosjektet var en metodekontrollstudie, og det krevdes derfor ikke særskilt samtykke eller søknad om godkjenning fra Regional etisk komité (REK).
Prøvemateriale
Det ble tatt prøver fra 24 utvalgte blodgivere som enten hadde (i homozygot eller heterozygot form) eller manglet de aktuelle blodtypeantigenene på erytrocyttene sine. Alle blodgiverne var blodtype O. Ved blodtapping fylles først en prøvetakingspose på 50 mL før selve tappeposen. I prøvetakingsposen var det nok materiale til både rutineprøver og de to ekstra glassene, ett ACD-glass og ett CPDA-glass. Prøve fra erytrocyttposen ble tatt ved å sveise av en liten del av slangen på posen. Prøvene av blodgiverne var merket med tappenummer.
Analysering
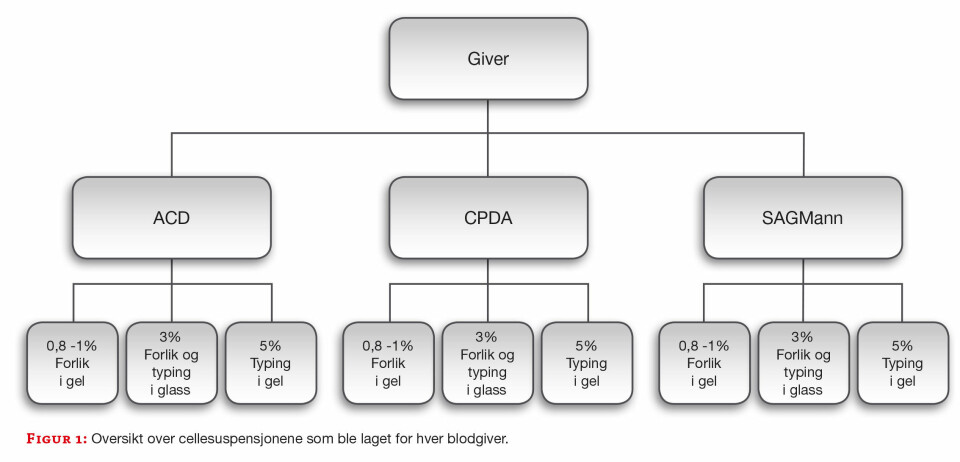
Fra hver blodgiver fikk vi tre prøver; henholdsvis fra erytrocyttkonsentratet med SAGMann, ACD-glass og CPDA-glass. Det ble laget cellesuspensjoner på dag 1 og 35 i henhold til figur 1.
Prøvene ble:
- Fenotypet på antigenene D, c (lille c), K, M, S, Fya og Jka
- Brukt til utvidet forlik med indirekte antiglobulinteknikk (IAT) i gelkort (LISS/Coombs, Bio-Rad)
- Brukt til utvidet forlik med IAT i glass.
Teknikkene som ble benyttet i prosjektet er godt etablerte teknikker enten de gjøres i gelkort eller glass (3). Samme person analyserte prøvene både på dag 1 og dag 35.
Antigentyping: Antigentypingene ble utført med kommersielle typesera og med den teknikken som leverandøren av de respektive typeseraene anbefaler; D (Novaclone, IMMUCOR), c (lille c) og K (gelkort, Bio-Rad) M, S, Fya og Jka (Bio-Rad). Resultatene av agglutinasjonsreaksjonene ble gradert etter en etablert skala fra negativ til 4+ reaksjon (8). Graderingene ble gjort om til tallverdi/score (tabell 1) før den statistiske bearbeidelsen av resultatene (8).

Utvidet forlik: Til utvidet forlik ble det benyttet 27 immunsera med kjente blodtypeantistoff. Immunseraene var restplasma/serum fra eksterne kvalitetskontroller som Blodbanken i Oslo deltar i, samt noen pasientprøver. Pasientprøvene ble avidentifisert før analysering. Tilgangen på immunsera var begrenset, og derfor ble ikke alle seraene brukt til forlik i glassteknikk. Noen immunsera ble ikke satt opp mot alle 24 blodgivere. Fordeling på immunseraene var: fem anti-D, fire anti-c (lille c), fire anti-K, fem anti-M, to anti-S, fire anti-Fy a og tre anti-Jk a. Noen av immunseraene ble fortynnet for å ha antistoff med ulik styrke (titer), for å følge opp teorien i studiene fra 1959 og 1964, om at antigen svekkes ved lagring (6,7). Det var derfor forventet at de ulike immunseraene skulle gi forskjellig styrke på de positive reaksjonene, eventuelt også negative reaksjoner med noen av cellene. Immunseraene ble oppbevart i kjøleskap under de to analyseringsperiodene, som hver var på fem arbeidsdager, men frosset mellom dag 1 og dag 35.
Statistikk
Statistikkprogrammene Analyse-IT ® (statistisk analyseprogram for Microsoft Excel, Analyse-it Software, Ltd.) og IBM® SPSS® Statistics 21 ble benyttet til statistisk bearbeiding av antigentyperesultatene.
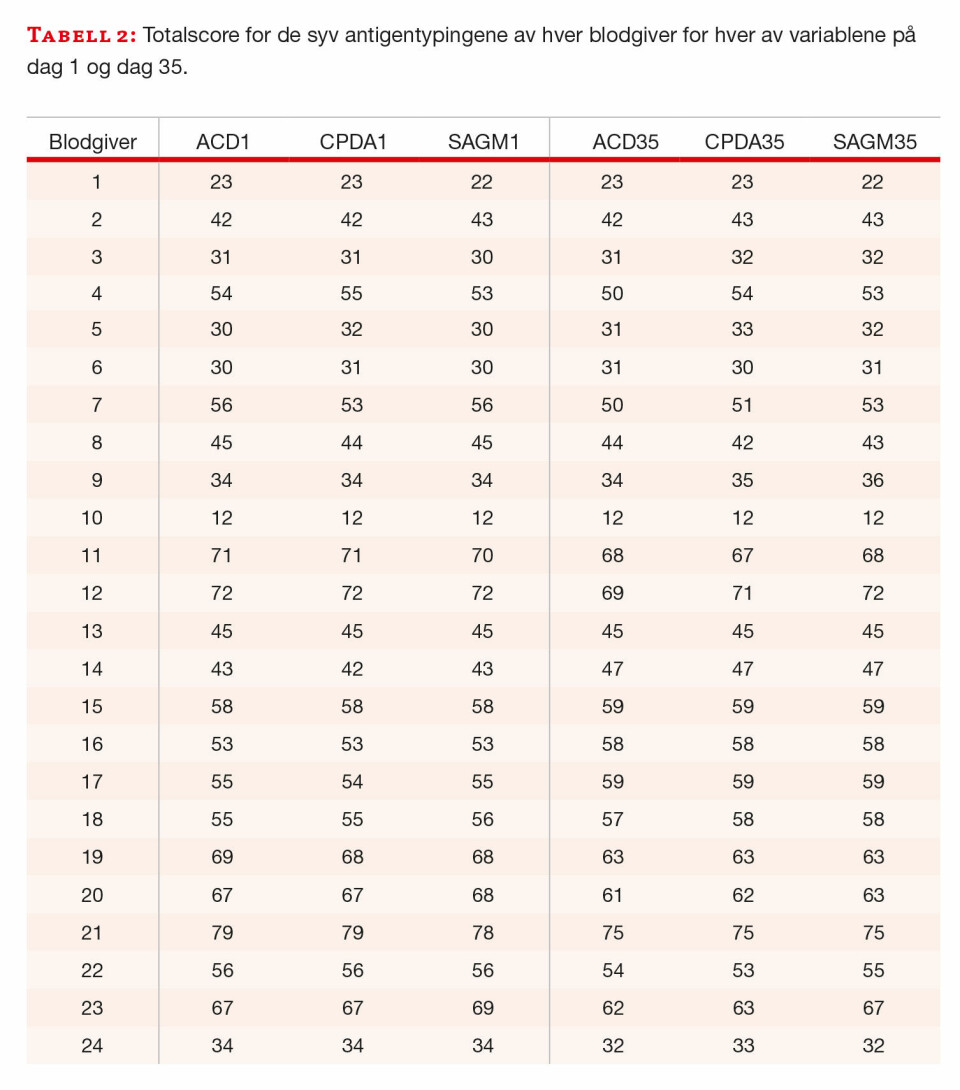
Agglutinasjonsreaksjonene fra antigentypingene ble gjort om til score og summert til en totalscore for alle typingene i hver av de tre prøvene fra de enkelte blodgiverne. Alle blodgiverne ble typet på dag 1 og dag 35 og vi fikk dermed seks sammenlagte summer (totalscore), tre for dag 1 og tre for dag 35, for hver av de 24 blodgiverne.
Alle statiske analyser ble gjort som parvise data der totalscoren for hver giver fra de ulike lagringsmediene ble analysert respektivt. Shapiro-Wilkstest ble benyttet for å vurdere om dataene var normalfordelte. Deretter ble totalscore for antigentyping i hvert av lagringsmediene sammenlignet ved å benytte paret t-test og Wilcoxon test for henholdsvis parametriske og ikke-parametriske data (9,10). I tillegg benyttet vi Bland-Altman differanseplot for å kunne vurdere grad av samsvar mellom to og to lagringsmedier på dag 1, på dag 35 og for samme lagringsmedium mellom dag 1 og dag 35. Differansen mellom to og to typer pilotglass, eller samme type pilotglass dag 1 og dag 35, ble satt opp mot gjennomsnittet i score for de aktuelle pilotglassene (9,10).
Det ble ikke gjort statistiske beregninger på forliksresultatene. Resultatene ble vurdert med tanke på om det ble negative resultater mot antigen-negative celler og positive resultater mot antigen-positive celler. Avvikende resultater ble undersøkt med tanke på om det var hyppigere avvikende resultater i noen av lagringsmediene eller mellom dag 1 og dag 35.
Resultater
Antigentyping
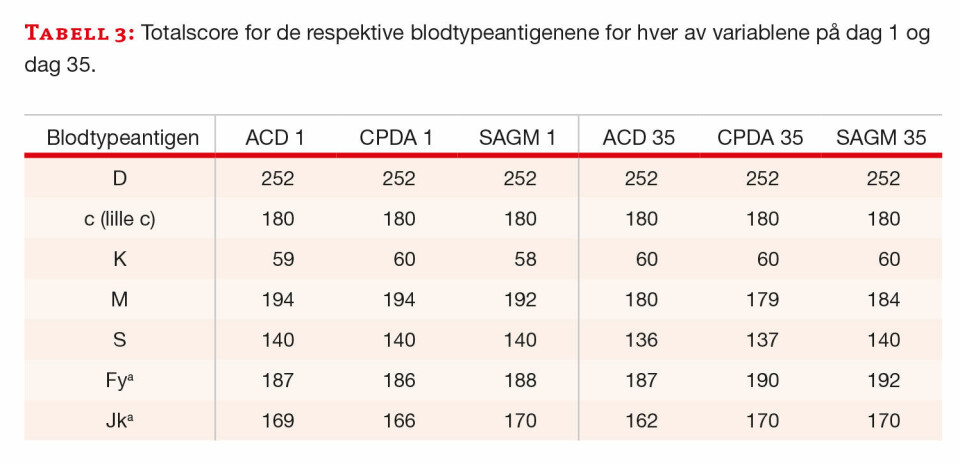
Erytrocytter fra 24 blodgivere fra pilotglass med ACD eller CPDA og slangesegment (SAGMann) ble typet på D, c (lille c), K, M, S, Fya og Jka på dag 1 og dag 35. Det var ingen falske positive eller falske negative reaksjoner. Alle reaksjonene ble tatt med i den statistiske bearbeidingen etter at graderingen var gjort om til score. Scorene ble summert for hver blodgiver og de tre lagringsmediene på dag 1 og dag 35 (tabell 2). I tillegg ble totalscore summert for hvert antigen i de ulike lagringsmediene for dag 1 og dag 35 (tabell 3).
Shapiro-Wilkstest viste at alle variablene fra både dag 1 og dag 35 var normalfordelt på 5 % signifikansnivå.
Paret t-test viste ingen statistisk signifikant forskjell mellom ACD, CPDA og SAGMann dag 1, eller for de enkelte lagringsmediene mellom dag 1 og dag 35. På dag 35 var det ingen signifikant forskjell mellom ACD og CPDA eller mellom CPDA og SAGMann, men statistisk signifikant forskjell mellom ACD og SAGMann. Forskjellen var 0,9 (0,3-1,5); p< 0,01 (tabell 4). Det var ingen statistisk signifikant forskjell i variablene mellom dag 1 og dag 35 (tabell 4).
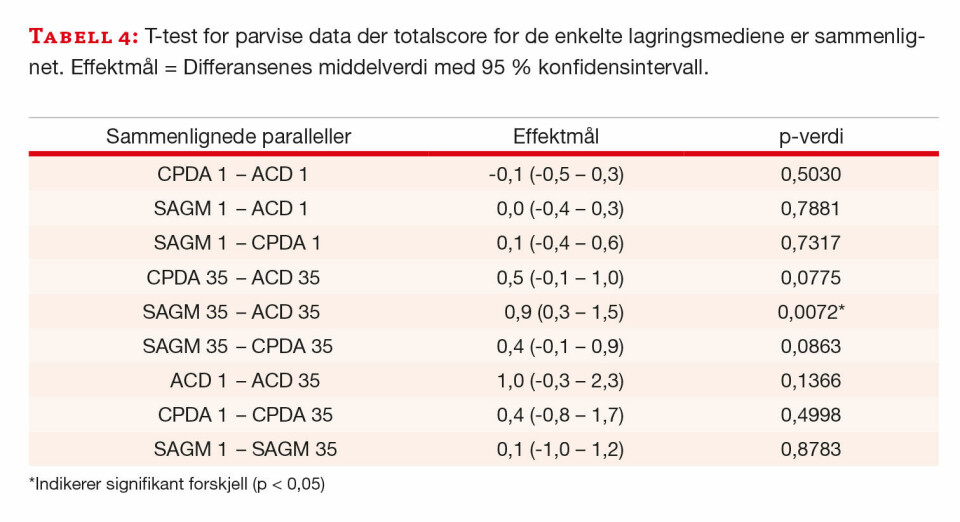
For å undersøke om et av lagringsmediene oftere viste høyere score enn de andre, benyttet vi Bland-Altman plott der to og to variabler ble sammenlignet. Til sammen ble ni Bland-Altman plott analysert. CPDA-glasset ga i flere tilfeller høyere totalscore enn ACD-glasset ved dag 35, uten at forskjellen var statistisk signifikant. Videre ga SAGMann høyre totalscore i flere tilfeller enn CPDA, både ved dag 1 og dag 35. ACD, CPDA og SAGMann ga i flere tilfeller en høyere totalscore på dag 1 enn dag 35. Heller ingen av disse forskjellene var statistisk signifikante. På dag 35 ga SAGMann signifikant høyere totalscore enn ACD.
Utvidede forlik
I studien ble det gjort 4545 utvidede forlik, 1116 i glassteknikk og 3429 i gelteknikk. Resultatene fra forlikene ble gjennomgått med tanke på avvikende reaksjoner. Da det ikke var noen falske positive reaksjoner, vil avvikende reaksjoner være reaksjoner som var forventet å bli positive, men som ble negative på dag 1 eller dag 35 i ett eller flere av lagringsmediene (ACD, CPDA og SagMann) eller i alle lagringsmediene både dag 1 og dag 35.
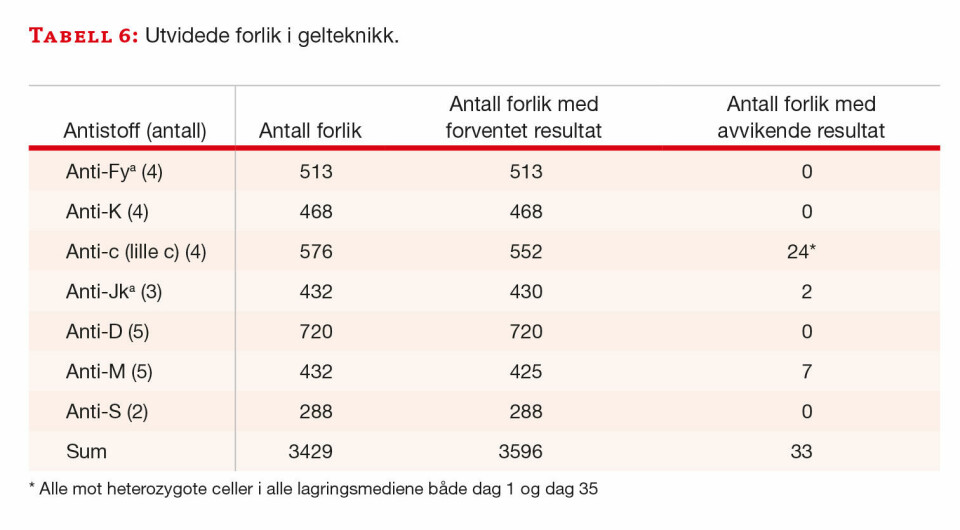
I glassteknikk var det 25 avvikende resultater (tabell 5), mens det i gelteknikk var 33 avvikende resultater (tabell 6).
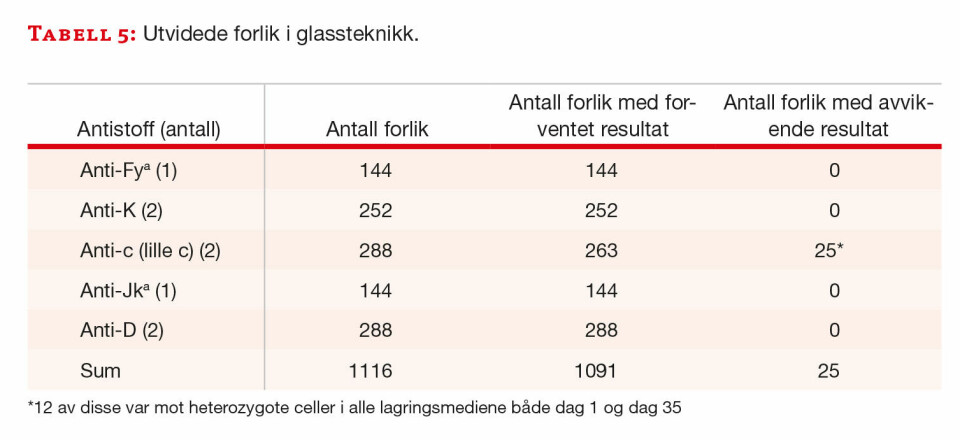
Glassteknikk: Ett anti-c (lille c) med lavt titer ga avvikende reaksjoner mot seks blodgivere. Immunserumet ga negative reaksjoner med alle tre typer lagringsmedium, både på dag 1 og dag 35 mot to blodgivere som var heterozygote og en blodgiver som var homozygot for c-antigenet. Mot en blodgiver som var heterozygot for c-antigenet ga immunserumet 2+ reaksjoner på dag 1 og negative reaksjoner på dag 35. For to blodgivere (en homozygot og en heterozygot for c antigenet) ga immunserumet svake positive reaksjoner på dag 1, og negative reaksjoner med ACD- og CPDA-glass på dag 35, mens det med SAGMann ga 0,5+ reaksjon.
Gelteknikk: Det samme anti-c (lille c) som viste noen avvikende resultater t i glassteknikk, ga også avvikende resultater ved oppsett i gelteknikk mot fire av blodgiverne som var heterozygot for c-antigenet. Ett anti-Jka viste svak reaksjon mot én giver, dag 1 i CPDA-glass og dag 35 i SAGMann. To anti-M viste også noe varierende reaksjoner mot to av blodgiverne som var M positive. De avvikende reaksjonene var fordelt på begge typer pilotglass og i prøver fra SAGMann-posen, både på dag 1 og dag 35.
Diskusjon
I denne studien skulle vi undersøke om det var forskjell i konservering av blodtypeantigen avhengig av om erytrocyttene ble oppbevart i pilotglass med ACD og CPDA eller i erytrocyttkonsentratet med SAGMann. Til dette ble det benyttet antigentyping og gjort utvidet forlik mot et utvalg av antigener fra de klinisk mest viktige blodtypesystemene.
Antigentyping
Vi fikk ingen falske negative resultater ved typing på de syv valgte blodtypeantigene. Ettersom uttrykk av de utvalgte antigenene varierte og antall positive reaksjoner har betydning for forskjellene i tallverdien mellom de ulike antigenene, ble det relativt stor forskjell i score mellom blodgiverne. Typing på K antigenet gir lavest scoresum, og det skyldes at de fleste blodgiverne er K-negative (som gir 0 i score).
Typing på blodtypeantigen gjøres med antisera som gir sterke reaksjoner (2 til 4+). Den statistiske forskjellen på 0,9 i score i ACD sammenlignet med SAGMann på dag 35 kan for eksempel bety at en positiv reaksjon graderes til 3+ i ACD-glass, mens den graderes til 3,5+ i SAGMann. Begge reaksjonene er tydelig og utvilsomt positive. I tillegg til å beregne signifikans av forskjeller ble det også gjort en kvalitativ vurdering av betydningen av disse. Forskjellen mellom ACD og SAGMann på dag 35 har ingen klinisk eller praktisk betydning da de positive agglutinasjonsreaksjonene i alle lagringsmediene er sterkt positive og dermed enkle å lese av. Falske negative reaksjoner kunne potensielt ha ført til en feiltransfusjon, men ble altså ikke observert.
Blodbanken har brukt ACD-glass som pilotglass i 35 dager, tilsvarende holdbarheten til SAGMann-erytrocyttkonsentrat, til tross for at oppgitt holdbarhet på ACD-glass er 21 dager. Dette er gjort i mange år før CPDA-glassene kom på markedet og det har ikke vært dokumentert problemer i forbindelse med bruk av ACD-glass. Leverandørene av pilotglassene er ikke kjent med at det har blitt gjort noen sammenligningsstudier av de to pilotglassene, men henviser til litteraturen om at CPDA-glasset stabiliserer blodet lengre enn ACD-glasset (11). Siste kjente studie vi har klart å finne med tanke på konservering av blodtypeantigener i pilotglass er fra 1964 (7).
Det ble observert flere forskjeller i antigenkonservering mellom de ulike lagringsmediene, men den eneste av disse som var statistisk signifikant var forskjellen mellom SAGMann og ACD på dag 35. Til tross for at forskjellen var statistisk signifikant, var den liten og uten klinisk relevans.
Utvidede forlik
Immunantiseraene hadde ulik styrke/titer og noen var i tillegg bevisst fortynnet til et nivå rundt deteksjonsgrensen. Det var derfor forventet at noen av disse ikke ville gi positiv reaksjon mot alle cellene som var positive for det aktuelle antigenet. Immunsera med lavt titer var primært med i oppsettene for å se om en svak positiv reaksjon på dag 1 også var tilstede på dag 35 og om det var forskjell mellom de ulike lagringsmediene. I noen tilfeller var antistoffet for svakt og ga negative reaksjoner begge dagene. I prosjektet ble det utført 4545 forlik, og bare en svært liten andel viste avvikende resultater (tabell 5, 6). De avvikende reaksjonene syntes å være tilstede i begge pilotglassene og i SAGMann i tilnærmet lik frekvens. Dette indikerer at årsaken til de avvikende resultatene like gjerne er forhold med immunseraene eller analyseringen, som at antigenene ble svekket under lagring in vitro.
Sussman og Butler (7) og Linins et al. (6) sine studier er over 50 år gamle, og metoder og teknikker som da ble brukt, kan ikke helt sammenlignes med de som brukes i dag. I tillegg brukte de svært få prøver i studiene. I vår studie kan vi verken ved typing eller utvidet forlik se at K eller Fya har blitt signifikant svekket etter 35 dager i ACD. Ved typing av antigenet c (lille c) fant vi at reaksjonene var like sterke dag 1 og dag 35 (tabell 4), men ved forlik med anti-c (lille c) fikk vi noen falskt negative funn. I noen få tilfeller fikk vi en positiv reaksjon ved dag 1 og negativ ved dag 35 (tabell 5, 6). Om de negative reaksjonene skyldes at antigen c (lille c) ble svekket under lagring, kan vi ikke si noe sikkert om, da utvalget var for lite. Årsak til de avvikende funnene kan også være tekniske feil ved analysering eller at immunserumet ble svekket ved nedfrysning og opptining mellom dag 1 og dag 35. Derfor kunne det vært interessant å utføre en større studie med flere immunsera med lave titer.
I «Veileder for transfusjonstjenestene i Norge» (1) er det tatt høyde for at immunantistoff kan være svake (ha lavt titer). Derfor stilles det krav om at minst en av cellene til antistoffscreening skal være homozygot på alle de klinisk viktigste blodtypeantigene. Pasienter som har fått påvist irregulære blodtypeantistoffer skal ha blod som er typet negativt to ganger på tilsvarende antigen og det skal gjøres utvidet forlik (1). Den ene typingen kan i noen tilfeller erstattes av utvidet forlik, men ikke for svake antistoffer som bare reagerer med homozygote celler (1).
Ved metodesammenligningsstudier er det anbefalt å analysere minimum 20-40 prøver som er fordelt på alle aktuelle konsentrasjonsnivåer (12). Vi analyserte prøver fra 24 forskjellige blodgivere. Immunsera er en begrenset ressurs og det hadde betydning for antall prøver, men vi hadde med immunsera med ulike titer slik at ulike konsentrasjonsnivåer av immunantistoff var representert. Gradering av agglutinasjon kan variere noe fra person til person, særlig for de svakeste reaksjonene. Betydningen av dette ble redusert ved grundig opplæring i gradering ved oppstart, bruk av mal for gradering og at samme person analyserte prøvene dag 1 og dag 35. Det er spesielt avlesing med glassteknikk som krever erfaring. For kraftig oppristing av pelleten kan nemlig resultere i svakere gradering.
Konklusjon
Totalt sett observerte vi få og små forskjeller for konservering av blodtypeantigen i de ulike lagringsmediene. I praksis vil de observerte forskjellene mellom SAGMann og pilotglass med både ACD og CPDA ha liten klinisk betydning.
























