Fag i praksis
Målingen af MCV er fejlbehæftet! Brug derfor MCH til anæmiudredning
Både EVF og MCHC beregnes ud fra bl.a. MCV, og dermed er disse kvantiteter også behæftet med usikkerhed.MCHC tilfører ingen ny information, ud over hvad der kan ses af MCH.
Af JENS PETER PHILIPSEN og KIRSTEN VIKKELSØ MADSEN
Målingen af MCV er fejlbehæftet! Brug derfor MCH til anæmiudredning.pdf(302 KB)
Med baggrund i egne undersøgelser og videnskabelig litteratur beskrives kendte fejlkilder på bestemmelsen af erythrocytters Middel Celle Volumen (MCV). Fejlkilder, som også resulterer i fejlagtige beregninger af B-erythrocytvolumenfraktion (EVF) og B-Erythrocyt (B-Ery), middel-hæmoglobin, stofkonc. (MCHC). Kvantiteten Middel Celle Hæmoglobin (MCH) er ikke så fejlbehæftet og giver bedre information ved anæmiudredning.
Det anbefales derfor, at MCH bruges til anæmiudredning fremfor MCV. EVF, MCV og MCHC kunne altså godt slettes fra analyserepertoiret uden at fejldiagnosticere eller fejlbehandle af den grund, dog med det forbehold, at Polycytæmi Vera-patienter kan få udført en manuel EVF.
Historisk baggrund
I 1929 introducerede Maxwell M. Wintrobe (1901-1986), der fik klinisk hæmatologi etableret som medicinsk subspeciale, en præcis og nogenlunde korrekt metode til bestemmelse af EVF (1). Wintrobe beskrev også beregning af MCV, MCH og MCHC (2) samt klassifikation af anæmier ud fra disse (3).
I hæmatologiens spæde opstart var kvaliteten af målingerne betydelig anderledes end i dag. Også mængden af krævet prøvemateriale var en del større. Wintrobes bestemmelse af EVF var en såkaldt makro-hæmatokrit, som krævede ca. 1 mL blod og et rør, der var ca. 10 cm langt. Selvom centrifugeringstiden var mindst ½ time, blev der lidt plasma tilbage mellem erythrocytterne, såkaldt ”trapped plasma”, som resulterer i falsk forhøjet EVF. Med mikrohæmatokrit-metoden, som bruges i dag, hvor der benyttes ca. 75 µL fuldblod, er mængden af ”trapped plasma” væsentlig mindre. Denne måling kan udføres meget præcist (CV < 0,5 %) og med korrektion i henhold til The International Council for Standardization in Haematology (ICSH) (4) også meget korrekt.
Wintrobes måling af EVF var mere pålidelig end målingen af B-hæmoglobin (B-Hb) og især bestemmelsen af antallet af B-Ery. Derfor blev bestemmelsen af MCV (EVF/Ery) og MCH (Hb/Ery) tilsvarende upræcise.
I 1953 fik Wallace Coulter patent på sin opfindelse af impedansprincippet til tælling og størrelsesbestemmelse af diverse partikler, herunder B-Ery, B-thrombocytter og B-leukocytter. Dette gjorde erythrocyt-tællingen meget mere præcis. Den elektriske impuls, der dannes, når en celle passerer tælle-hullet, er nogenlunde proportional med cellens størrelse. Dog påvirkes målingen også af antikoagulanset, osmolaliteten i plasma og cellernes viskositet (~MCHC).
EVF på hæmatologiapparaterne blev kalibreret over for en centrifugeret EVF, som kunne være korrigeret for ”trapped plasma”. Mængden af ”trapped plasma” blev målt ved at tilsætte radioaktivt albumin eller fibrinogen og målte radioaktiviteten i erythrocytlaget. Derved var det muligt at beregne, hvor meget plasma der var fanget mellem erythrocytterne. Målingerne varierede dog fra 1,3-3,2 %, dvs. de var ret upålidelige. Coulter Electronics, der i kraft af deres patent var enerådende på markedet, valgte i 1974 at korrigere deres kontroller på MCV og dermed EVF ned med ca. 3 %.
Dengang var det udbredt praksis at kalibrere på kontrollerne, så pludselig faldt EVF og MCV med 3 %, mens MCHC steg med 3 % (5). Med ICSH’s nuværende referencemetode er korrektionen kun ca. 0,7 %. Fejlen på +0,7 % blev ændret til en fejl på -2,3 % ved denne overkorrektion. Selvom Coulter efter patentets udløb fik mange konkurrenter, overtog disse tilsyneladende denne fejlagtige korrektion.
Tilbage til nutiden
I løbet af de næsten 100 år, der er gået siden Wintrobe præsenterede hæmatokritten, er præcisionen på hæmatologiudstyr blevet betydeligt bedre. På disse apparater måles/tælles B-Hb, B-Ery og MCV. På basis af disse beregnes:
EVF = Ery x MCV
MCH = Hb/Ery
MCHC = Hb/(Ery x MCV)
På trods af mange års erfaring inden for hæmatologiske målinger findes der stadig fejlkilder på de målte kvantiteter. Eksempelvis målingen af B-Hb, hvor uklarhed eller turbiditet giver falsk forhøjede værdier, da det absorberer lys. Det ses især ved lipæmiske prøver, men det kan også med nogle metoder (men ikke alle) ses ved højt leukocyttal. Dermed bliver MCH og MCHC ligeledes falsk forhøjet.
En anden fejlkilde kan være, hvis plasma indeholder kuldeagglutininer, hvor erythrocytterne klumper sammen ved stuetemperatur. Disse klumper bliver enten ikke talt med eller kun som én erythrocyt, derfor bliver erythrocyttallet for lavt. MCHC bliver oftest meget forhøjet ved kuldeagglutininer. Massiv hæmolyse vil også reducere antallet, men det ses sjældent i praksis. Ved meget højt leukocyttal kan især små lymfocytter interferere med målingen, da de forveksles med erythrocytter og dermed tælles som erythrocytter og ikke leukocytter (6).
Typen af antikoagulans kan også påvirke MCV. Erythrocytterne skrumper 2-3 %, hvis blodprøven tages i et K3EDTA- fremfor K2EDTA-stabiliseret glas (7). Herved forrykkes målingerne, så 7 % af ”raske” patienter kommer under referenceintervallet, mens kun 0,7 % kommer over referenceintervallet (figur 1).
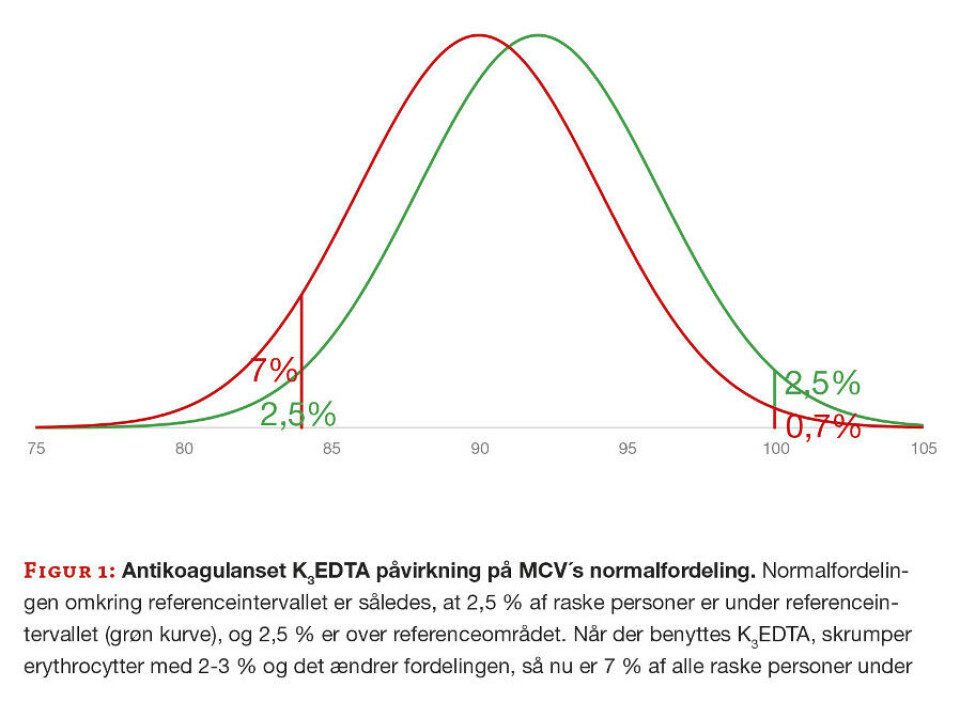
Hvis prøvetagningsrøret ikke fyldes tilstrækkeligt, så koncentrationen af antikoagulanset stiger ses noget tilsvarende (8). K2EDTA blev allerede i 1993 anbefalet af ICSH som antikoagulans til hæmatologiske analyser (9), så det burde for længst være indført på alle laboratorier.
Kuldeagglutininer, lipæmi og lav osmolalitet /lav P-Natrium (P-Na) kan opdages ved, at MCHC bliver forhøjet. MCHC-værdier over 22,6 mmol/L skyldes faktisk altid en fejlmåling. Der er ikke en tilsvarende grænse nedadtil.
Hvor godt skal det være?
Ønskelig analysekvalitet kan fastlægges i forhold til biologisk variation (10):
Præcision (CV %): ½ intraindividuel variation
Korrekthed (Bias %): ¼ total variation
Dermed skal såvel variationen inden for personen (= intraindividuel variation) kendes, samt populationens totale variation. Variationerne findes i European Federation of Clinical Chemistrys database (11). For MCV er total biologisk variation = 3,8 % og ønskelig bias derfor ≤ 3,8 %/4= 0,9 % eller ca. 0,9 fL, altså et ganske strengt ønske.
Mulige fejlkilder på måling af MCV
Kalibrering
Som beskrevet ovenfor så har flere producenter af hæmatologiudstyr tidligere leveret kalibratorer, hvor EVF var overkorrigeret for ”trapped plasma”. Derfor blev MCV beregnet til at være lavere end den egentlig er. Af samme grund er de fleste referenceintervaller for MCV angivet for lavt. Vurderet ud fra DEKS-resultaterne (tilsvarer Noklus eksternt kontrollprogram, red.anm.) ser det dog ud til, at denne fejlkalibrering over årene er blevet rettet.
P-Natrium/P-Osmolalitet
En hæmatologisk automatiseret analyse starter med en fortynding af blodprøven med en isotonisk væske, som har en osmolalitet svarende til 290 mOsmol/kg eller P-Na på 140 mmol/L. Dermed opretholder erythrocytten dens oprindelige volumen, da osmolaliteten inden i erythrocytten er tilsvarende osmolaliteten uden for erythrocytten. Hvis en patients plasma har en ændret osmolalitet i forhold til fortyndingsvæsken, vil det påvirke erythrocyttens størrelse. Væske passerer erythrocyt-membranen via osmose, indtil der er ens osmolalitet på yder- og indersiden af erythrocytten, hvorved erythrocyttens volumen vil ændres (figur 2). Dermed vil den målte MCV ikke afspejle patientens reelle MCV i kroppen (12).
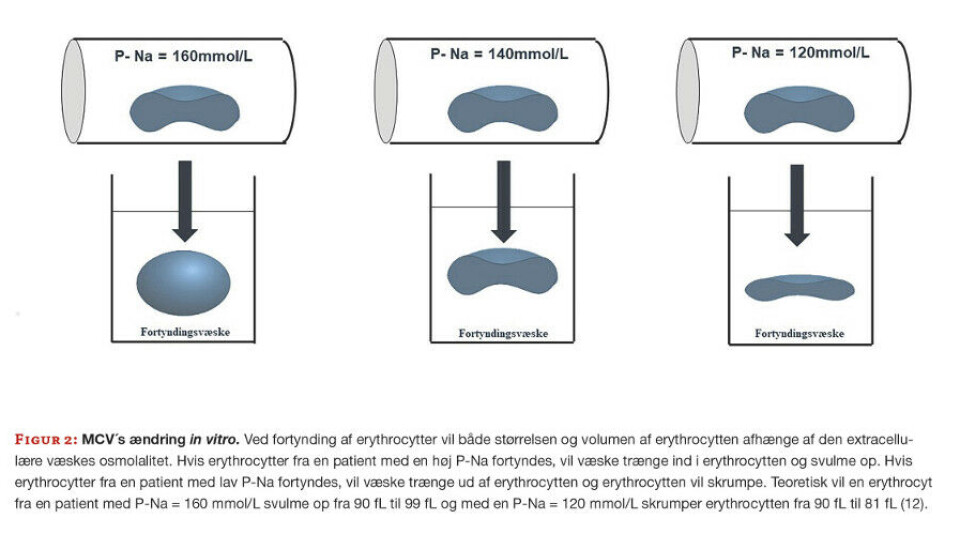
Natrium er den helt dominerende positive ion i plasma og er i almindelighed proportional med osmolaliteten. Ændringer i P-Na ændrer dermed den målte MCV. Også andre osmotisk aktive ioner, f.eks. P-Glucose og P-Carbamid kan påvirke plasmas osmolalitet og dermed resultere i forkerte målinger af MCV (13).
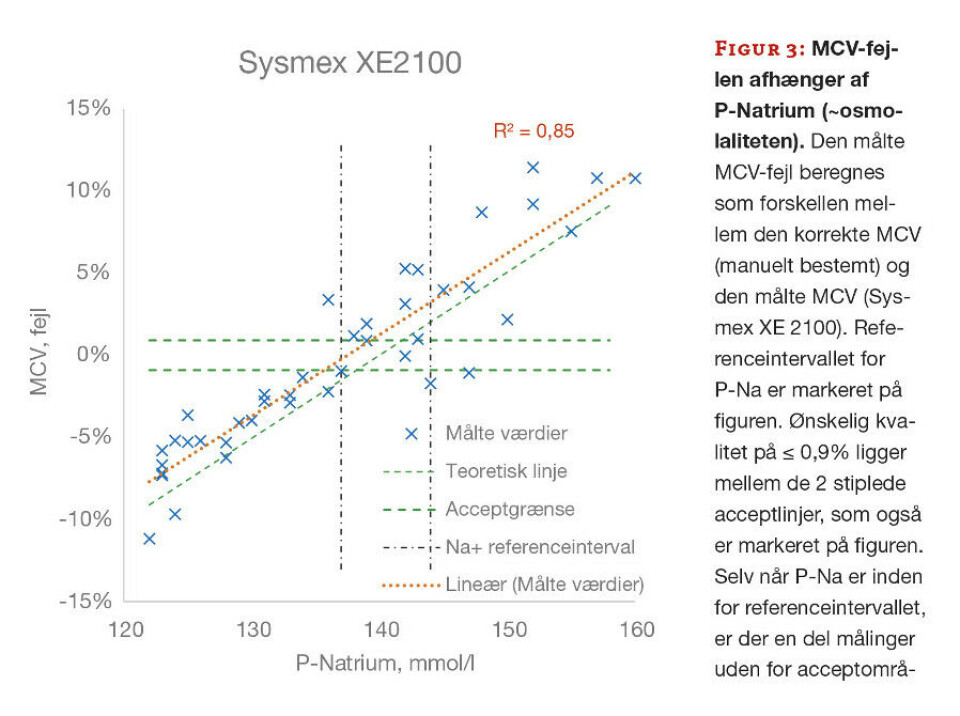
Hvis man vil undersøge, om ovennævnte teoretiske betragtninger også gælder i det virkelige liv, må man sammenligne en korrekt bestemt MCV med MCV-målingen på apparatet. Da den centrifugerede EVF ikke bliver fortyndet, er den uafhængig af patientens P-Na/osmolalitet. Apparaternes tælling af erythrocytter er også tilnærmelsesvis korrekt, og derfor kan man beregne en korrekt MCV: EVF/Ery. Forskellen mellem apparatets MCV-måling og den korrekte er fejlen på MCV, som det ses på figur 3. Dette eksperiment viser overordentlig god sammenhæng mellem, hvad man teoretisk kan beregne (grøn stiplet linje), og hvad der måles (rød stiplet linje) (12).
Patientcase
En patient indlægges på Hillerød Hospital med lav P-Na pga. behandling med thiazid, der virker vanddrivende, men også kan resultere i lav P-Na.
Tre uger inden indlæggelsen var patientens P-Na målt til 137 mmol/L og MCV var 89,4 fL, begge indenfor referenceintervallet og formodes at være korrekte. Ved indlæggelsen blev MCV målt til 81,8 fL (Sysmex XN9000) og P-Na var 108 mmol/L. Efter ophør med thiazid-behandling steg P-Na, og samtidig steg den målte MCV (figur 4A). Den procentvise MCV-fejl ses på figur 4B.
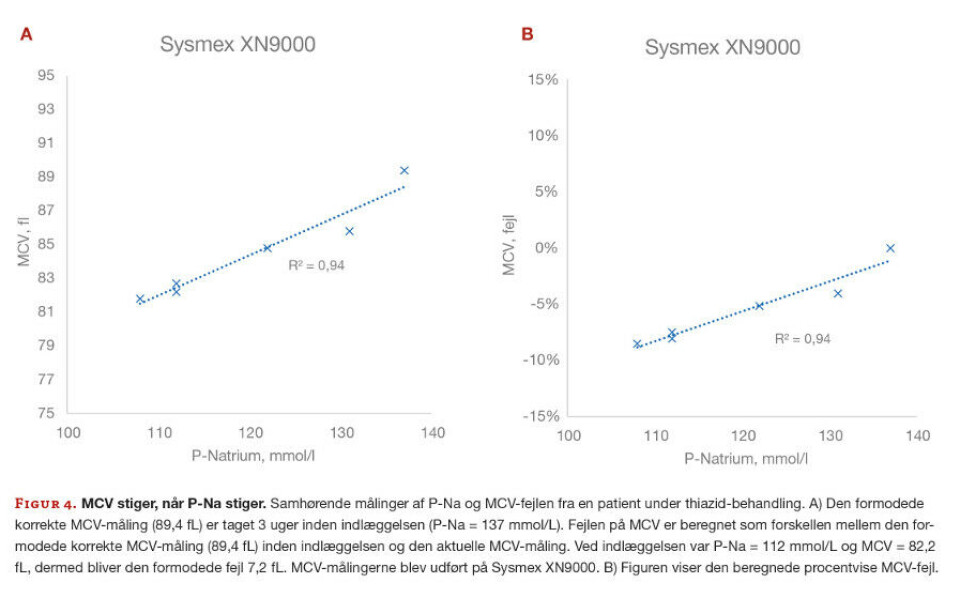
En ændring på 1 mmol/L P-Na resulterer altså i en fejl på 0,28 fL på MCV-målingen (Sysmex XN9000), se figur 4A, hvor tidligere eksperimenter har påvist en fejl på 0,47 fL, ved en ændring i P-Na på 1 mmol/L (Sysmex 2100) (12). Dette kan tyde på, at den nye Sysmex XN9000 er bedre til at måle en mere korrekt MCV end den tidligere udgave.
Ændring af MCV ved henstand
Ved valideringen af MCV på Nordsjællands Hospital i Hillerød blev MCV målt på 20 patientprøver efter 0, 2, 4, 6, 24, 48 og 72 timer. Når patientprøven opbevares ved 4° C, forbliver MCV-målingen nogenlunde uændret, også efter 72 timer, hvor MCV-fejlen er 1,7 %. Når blodprøven opbevares ved 20°C, er MCV-fejlen allerede efter 6 timer 1,7 % og efter 24 timer er fejlen 8,6 % (figur 5).
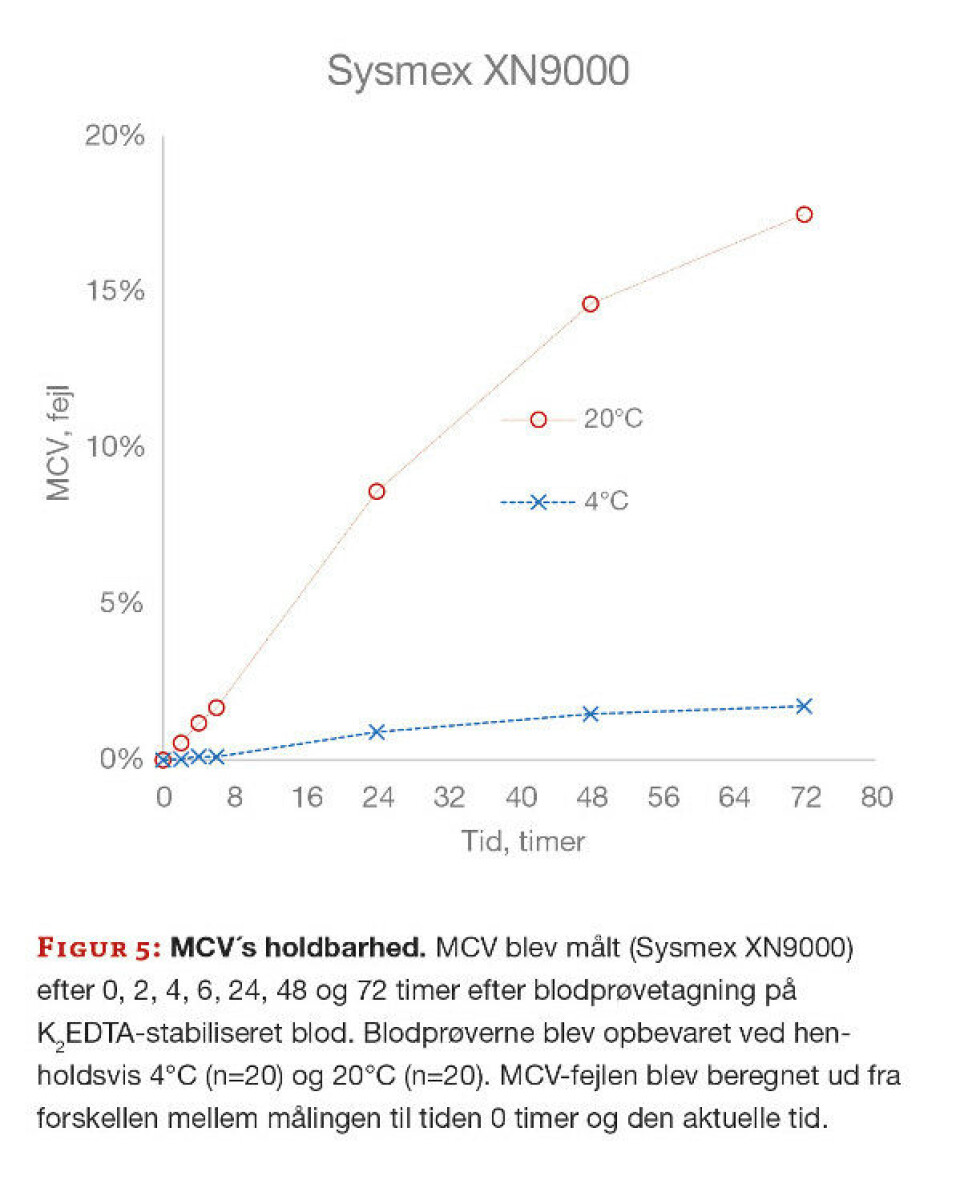
Mens B-Hb og B-Ery er holdbare over lang tid, gælder det samme absolut ikke for MCV. Hvis vi anlægger førnævnte krav til manglende korrekthed på <0,9 % vil prøverne kun være holdbare i ca. 3 timer. Det samme er også gældende for afledte kvantiteter som EVF og MCHC. MCH derimod ændrer sig ikke.
MCV-målingen påvirkes på nogle apparater af MCHC
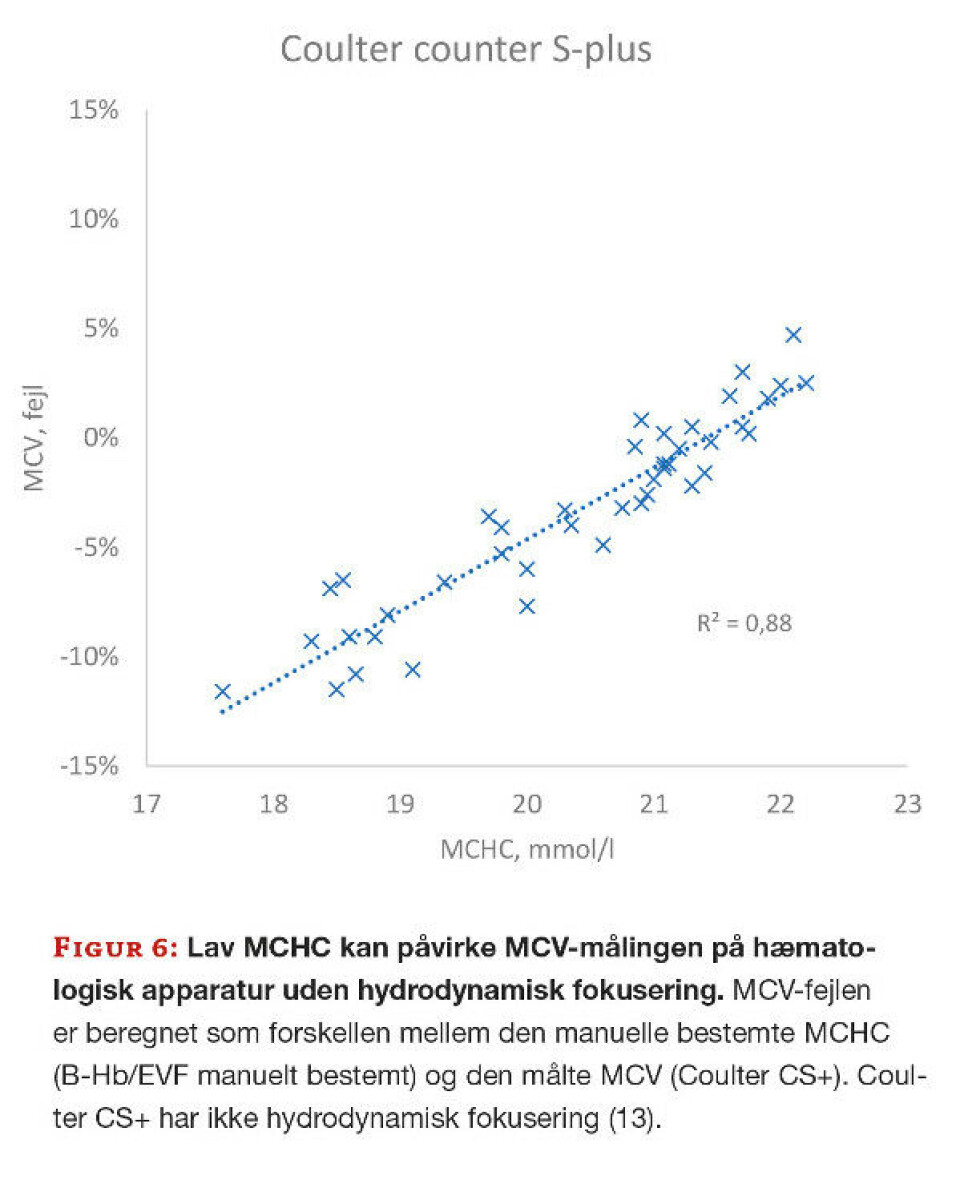
Hæmatologisk apparatur uden hydrodynamisk fokusering, som Coulter S+ eller nutidens POCT-udstyr, kan måle MCV forkert, især ved lav MCHC.
Ved lav MCHC vil erythrocyttens viskositet mindskes, og derfor bliver erythrocytten mere langstrakt, når den passerer tællehullet, så MCV måles mindre, end den reelt er. Denne fejlkilde har været kendt i mange år og nedenstående eksempel er fra en dansk undersøgelse i Ålborg (14). Som det kan ses på figur 6, måles erythrocytterne mindre ved lav MCHC, hvilket igen påvirker beregningen af MCHC og EVF.
En patient med Polycytæmi Vera (overproduktion af erythrocytter) får målt B-Hb og B-Ery på Sysmex XN9000 og manuelt bestemt EVF, hvorefter MCV og MCHC beregnes, således at de korrekte kvantiteter er:
B-Hb: 9,0 mmol/L
B-Ery: 7,5 x 1012/L
EVF: 0,52
MCV: 69,3 fL
MCHC: 17,3 mmol/L
Hvis målingen foregår på en Coulter S+, vil måle-fejlen på MCV være -13,5 % (69,3 fL-13,5 %) = 60 fL, altså 9,3 fL mindre end erythrocytten reelt er. Den beregnede MCHC bliver dermed også fejlbehæftet: (9 mmol/L)/(7,5 x 1012/L x 60 fL) = 20 mmol/L, hvor den reelt er 17,3 mmol/L. Tilsvarende er den beregnede EVF (7,5 x 1012/L x 60 fL) = 0,45, hvor den reelt er 0,52. Klinikerne vil på basis af EVF = 0,45 vurdere, at behandlingen er tilstrækkelig, men med en reel EVF på 0,52 er denne stadig alt for høj, og patienten bør tappes yderligere for blod. Denne fejl har gennem årene antagelig medført fejlbehandling af patienter med Polycytæmi Vera.
Det skal dog anføres, at apparater, der anvender isovolumetrisk sphæring (ADVIA) eller hydrodynamisk fokusering (Sysmex m.fl.), slet ikke, eller kun i begrænset omfang, har denne fejl.
Diskussion
Hurtig og korrekt diagnosticering af anæmi er tidsbesparende og økonomisk fordelagtigt både for den enkelte patient, for sundhedsvæsnet og for hele samfundet. Derfor er det vigtigt, at de målte kvantiteter, der diagnosticeres ud fra, er så korrekte som muligt. Denne artikel gennemgår mange kendte fejlkilder på målingen af MCV. Da MCV indgår i beregningen af EVF og MCHC, vil disse kvantiteter også være fejlbehæftede, hvis MCV er målt ukorrekt.
Heldigvis har påvisningen af mange fejlkilder resulteret i ændrede procedurer på laboratorierne, f.eks. benyttes K2EDTA fremfor K3EDTA som antikoagulans til hæmatologiske prøver.
Angående indsendte prøver fra praktiserende læger, hvor transporttiden og opbevaringen undervejs kan variere betydeligt, er transporten en betydelig fejlkilde for især MCV. Problemet kan reduceres ved at opbevare prøven ved 4°C indtil analysering. En reel løsning er at benytte MCH i stedet for MCV, da MCH beregnes ud fra B-Hb og B-Ery. Der kan selvfølgelig også være fejl på målingerne af B-Hb og B-Ery, men disse fejl er ikke så hyppige. MCH kunne derfor bruges som første indgang til anæmiudredning i stedet for MCV.
En anden MCV-fejlkilde er osmolaliteten i patientens blod. Hvis man ønsker en korrekt MCV, bør P-Na måles samtidig, og MCV-resultatet bør korrigeres til en P-Na på 140 mmol/L.
Patienter med Polycytæmi Vera behandles ud fra deres EVF, hvor målet for kvinder er EVF < 0,42 og for mænd < 0,45. I den sammenhæng er EVF en vigtig analyse, som skal bestemmes præcist og korrekt. For denne lille patientgruppe bør der udføres en manuel EVF. EVF burde altså være en specialanalyse forbeholdt disse patienter.
MCV, MCH og MCHC bruges først og fremmest til anæmiudredning. MCV og MCH følges i almindelighed ad, men som beskrevet er der mange fejlkilder på MCV. MCH er derfor efter vores opfattelse altid bedre end MCV. Til specielle anæmityper som thalassæmi, hvor der enten dannes for få α- eller β-kæder, er der ofte meget lav MCV og MCH. Her er MCH igen bedre end MCV. I den engelske screening for thalassæmi (15) er det også MCH, der bruges.
Konklusion
Konklusionen er, at målingen af MCV er fejlbehæftet, brug derfor MCH i anæmiudredningen! Både EVF og MCHC beregnes ud fra bl.a. MCV, og dermed er disse kvantiteter også behæftet med usikkerhed. MCHC tilfører ingen ny information, ud over hvad der kan ses af MCH. EVF, MCV og MCHC kunne altså godt slettes fra analyserepertoiret uden at fejldiagnosticere eller fejlbehandle af den grund, dog med det forbehold at Polycytæmi Vera-patienter kan få udført en manuel EVF. Ved at fjerne MCV, MCHC og EVF fra analyserepertoiret vil mængden af overflødig støj reduceres og dermed reducere risikoen for, at et vigtigt resultat overses.






















