FAG resymé
Nytt verktøy i jakten på nye antibiotikakandidater
Meticillinresistente gule stafylokokker er utbredt i mange land og kan forårsake alvorlige infeksjoner som er vanskelige å behandle. En studie ved Institutt for klinisk og molekylær medisin ved NTNU tar i bruk en ny metode for å undersøke virkningsmekanismen til to nye antibiotika-kandidater.
Av AMANDA HOLSTAD SINGLETON og MARIT OTTERLEI
Nytt verktøy i jakten på antibiotikakandidater.pdf(174 KB)
I Norge kan de fleste infeksjoner enkelt behandles med antibiotika. Men behandling av bakterielle infeksjoner blir sta-dig mer utfordrende på grunn av økende antibiotikaresistens både her i Norge og internasjonalt. Verdens helseorganisa-sjon (WHO) anslår at innen 2050 vil 10 millioner liv gå tapt årlig på grunn av antibiotikaresistens (1). Selv om antibioti-karesistens er en av de største truslene mot folkehelsen, utvikles det få nye antibiotika. For å sikre enkle behandlingsal-ternativer for fremtidens infeksjoner må vi investere i forskning og utvikling av flere antibiotika.
To nye antibiotikakandidater har en synergistisk effekt mot MRSA
I 2020 publiserte vi en studie om de bakteriedrepende egenskapene til en gruppe peptider som hindrer DNA-replikasjon ved å binde til det bakterielle proteinet β-clamp (2). Den mest lovende kandidaten i denne gruppen er peptidet BTP-001 (3). Samtidig drev forskerne ved Institutt for kjemi et arbeid med å utvikle nye antibiotikakandidater basert på en kjent DNA-synteseinhibitor. Ett av disse stoffene er JK-274, en brominert pyrrolopyrimidin. På laboratoriet så vi at BTP-001 og JK-274 effektivt dreper MRSA i kombinasjon, ved lavere konsentrasjoner enn ved enkeltbehandling, en såkalt synergieffekt (4). Konsentrasjonen av JK-274 som er nødvendig for å drepe MRSA reduseres med en faktor på åtte når den kombineres med BTP-001. At man får god effekt ved lavere konsentrasjoner av BTP-001 og JK-274 kan redusere potensielle bivirkninger i humane celler. Å angripe bakteriene på to ulike måter på samme tid, reduserer også sannsyn-ligheten for resistensutvikling.
Kostbart og tidkrevende
Bestemmelse av virkningsmekanismene er kritisk når en antibiotikakandidat vurderes for videre utvikling. Vanligvis tar det rundt ti år og over ti milliarder kroner å utvikle et nytt legemiddel. Derfor er det viktig å kun investere i de mest lovende kandidatene. En grundig forståelse av hvordan et stoff forårsaker bakteriedød kan gi verdifull innsikt om mulige resistensmekanismer og sekundære effekter.
Metode og sentrale funn
For å studere den bakteriedrepende effekten av BTP-001 og JK-274 i kombinasjon, optimaliserte vi en metode som tidligere er brukt for å studere signalsystemer i menneskeceller. Metoden kalles for «multiplexed kinase inhibitor bead assay» (MIB) og tar i bruk kinaseinhibitorer koblet til sepharosekuler for å fange aktiverte signalproteiner, som kinaser, og relaterte proteiner. Kinaseinhibitorene binder til ATP/GTP-bindingssetet bare i aktiverte kinaser/signal-proteiner eller proteiner i kompleks med disse (Figur 1). Deretter blir dette sub-proteomet analysert med massespektrometri som identifiserer hvilke proteiner som er dratt ned.
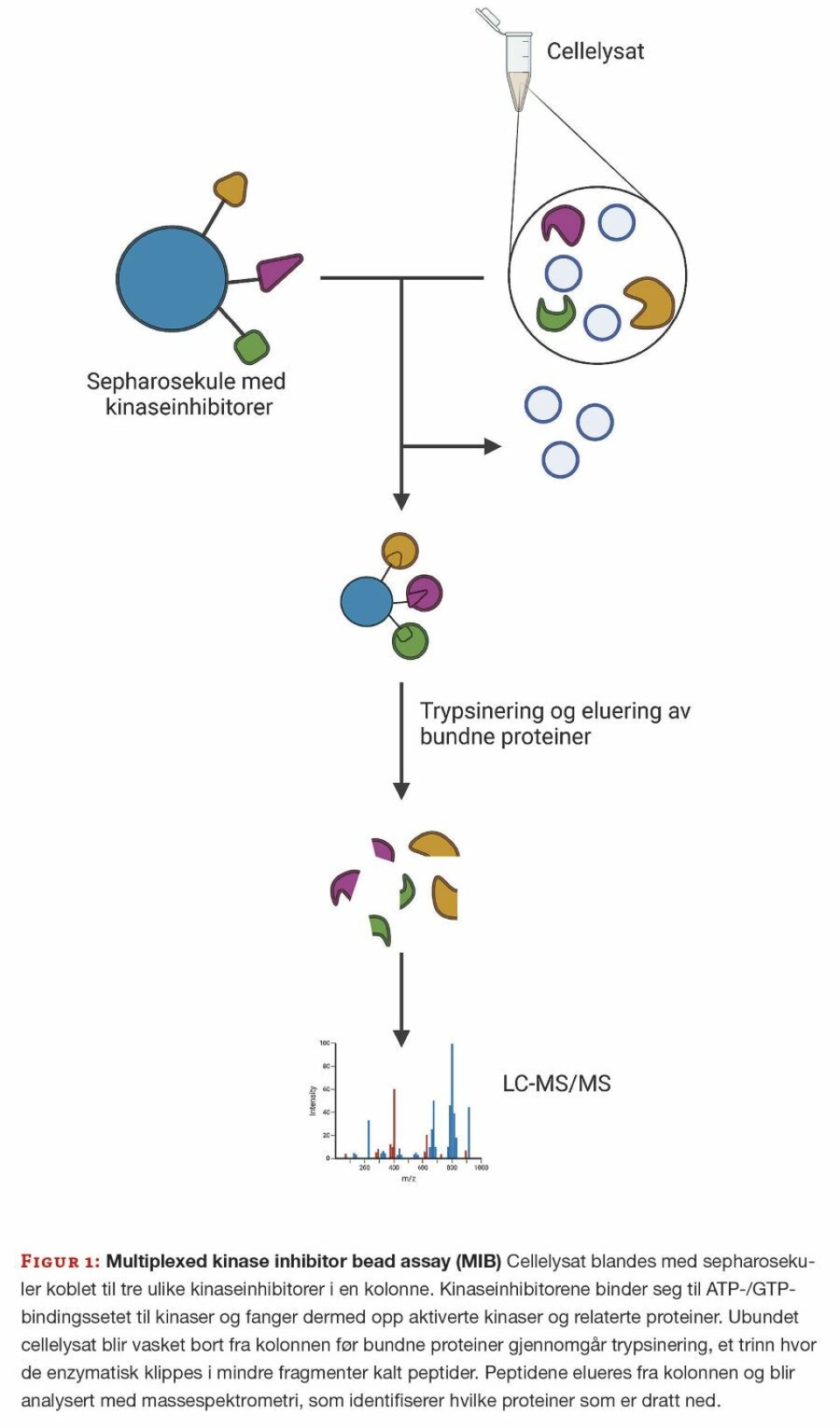
Ved å se på aktiverte signalproteiner og sammenligne med ubehandlet kontroll, får vi innsikt i hvilke prosesser som aktiveres eller deaktiveres i respons til behandlingen. For eksempel, ved behandling av gule stafylokokker med JK-274, detekterte vi lavere nivåer av aktiverte proteiner i sitronsyresyklusen sammenlignet med en ubehandlet kontroll, en indikasjon på at JK-274 hindrer energiomsetningen i bakteriecellen.
Strukturelle forskjeller i ATP/GTP-bindingssettet mellom proteiner i menneskeceller og bakterieceller fører ofte til ulik bindingsaffinitet til kinaseinhibitorer. Når vi brukte de samme kinaseinhibitorene til MIB som ble brukt til menneske-celler, detekterte vi svært få bakterielle signalproteiner. For å øke antall detekterte bakterielle proteiner, og dermed øke vår innsikt i bakterienes signalsystemer, testet vi fem nye kinaseinhibitorer syntetisert av våre samarbeidsparter på Insti-tutt for kjemi og Institutt for materialteknologi ved NTNU. Ved å ta i bruk to av disse kinaseinhibitorer i kombinasjon med en kommersiell kinaseinhibitor, klarte vi å øke affiniteten for bakterielle proteiner og dra ned 1568 proteiner fra gule stafylokokker (1).
Den nye MIB-metoden viser at den gode kombinasjonseffekten skyldes at BTP-001 og JK-274 til sammen aktiverer stressmekanismer i bakteriene som de hver for seg ikke aktiverer. Dette økte stresset fører til bakteriedød. De gode kombinasjonsresponsene i bakteriene tyder på at disse to stoffene kan være en lovende antibiotikakombinasjon, som burde studeres videre. Det er en lang vei fra laboratorieforsøk til BTP-001 og JK-274 kan brukes for å behandle infek-sjoner i mennesker, men med bedre innsikt i virkningsmekanismene kan man bedre forutse potensielle bivirkninger i humane celler. Derfor er denne studien og metodeutviklingen et viktig skritt i kampen mot økende antibiotikaresistens.























