FAG i praksis
Preimplantasjonsgenetisk testing:
Store fremskritt og krevende etiske dilemmaer
Preimplantasjonsgenetisk testing:
Store fremskritt og krevende etiske dilemmaer (pdf)
Om forfatterne:
- Molekylærgenetiker ved Avdeling for medisinsk genetikk (AMG) ved St. Olavs hospital. Mastergrad i genetikk og doktorgrad i kreftbiologi og inflammasjon. Ansvarlig for prenatal diagnostikk ved AMG-laboratoriet.
- Biolog ved fertilitetsseksjonen ved St. Olavs hospital. Master innen genetikk og doktorgrad i molekylærbiologi. Leder for flerregional behandlingtjeneste for PGT.
Innledning
Preimplantasjonsgenetisk testing (PGT) er en avansert teknikk innen assistert reproduksjonsteknologi, som brukes til å undersøke den genetiske sammensetningen av befruktede egg før implantasjon i livmor. PGT brukes til å identifisere embryoer med genetiske lidelser eller kromosomale avvik, slik at et embryo som ikke bærer den aktuelle lidelsen velges for implantasjon. PGT gir foreldre en mulighet til å gjennomgå en trygg graviditet selv i tilfeller hvor det er høy risiko for å overføre en genetisk sykdom. Dette øker sjansene for å føde friske barn, til tross for risikoen for alvorlige arvelige sykdommer eller kromosomale avvik.
PGT innebærer in vitro-fertilisering (IVF), og hvert enkelt par må vurderes både av en fertilitetsavdeling og en avdeling for medisinsk genetikk før de kan bli godkjent for denne behandlingen. For hvert enkelt par med monogen sykdom, må en testmetode utvikles for den aktuelle genetiske mutasjonen før de kan starte behandling. Dette skjer ved Igenomix i England og Spania (1-4).
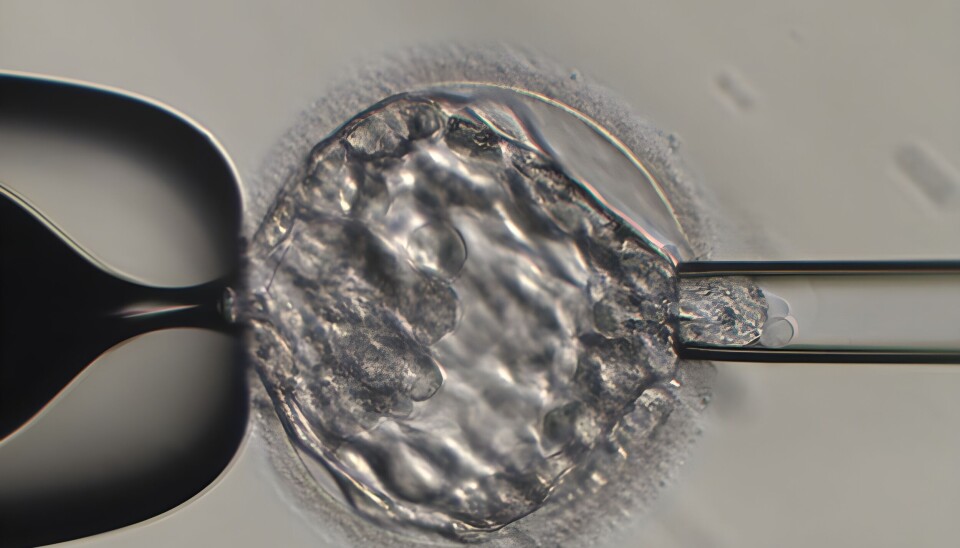
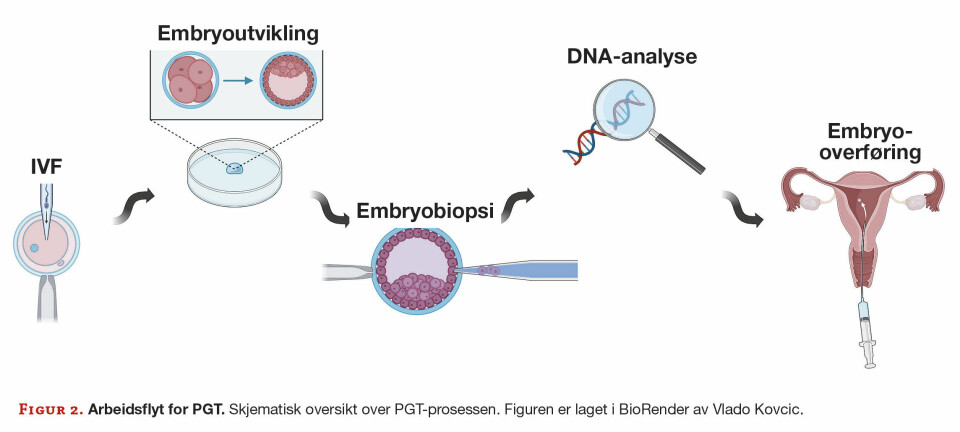
Når paret er godkjent, får kvinnen hormonbehandling for å produsere flere eggceller. Deretter hentes eggcellene ut og befruktes med mannens sædceller. Embryoene dyrkes i laboratoriet i fem til seks dager før det tas en biopsi som sendes til genetisk analyse med avanserte teknikker. Etter at biopsiene er tatt, vitrifiseres (fryses) embryoene i påvente av resultatene (2).
PGT omfatter flere typer testing (1, 5):
• PGT-A (Aneuploidi): Analyserer embryoer for unormalt antall kromosomer, for eksempel trisomier av kromosom 13, 18 eller 21, samt monosomi av kromosom X.
• PGT-M (Monogene sykdommer): Testing for spesifikke genetiske mutasjoner som kan føre til arvelige sykdommer, for eksempel cystisk fibrose.
• PGT-SR (Strukturelle avvik): Identifiserer embryoer med kromosomale avvik, for eksempel ved translokasjoner.
• PGT-HLA (Human Leukocyte Antigen): Identifiserer embryoer med en vevstype som er kompatibel med et sykt søsken for å muliggjøre stamcelledonasjon.
PGT har revolusjonert reproduktiv medisin ved å tillate foreldre å ta informerte beslutninger basert på genetisk informasjon, og dermed redusere forekomsten av genetiske sykdommer hos barn født gjennom IVF.
Bruk av PGT reiser etiske og juridiske spørsmål knyttet til genetisk seleksjon, embryomanipulasjon og mulig misbruk eller diskriminering. PGT gir klinikere og fremtidige foreldre muligheten til å velge embryoer med størst sannsynlighet for å utvikle seg til friske barn. I Norge er PGT strengt regulert, for å sikre forsvarlig bruk (1, 2, 5).
PGT-regulering og ESHRE-retningslinjer
Regulering av PGT varierer i ulike land, med spesifikke juridiske rammeverk, etiske hensyn og tekniske standarder som sikrer ansvarlig bruk. Disse reguleringene inkluderer ofte betingelser for testing, krav til informert samtykke, databeskyttelse og restriksjoner på ikke-medisinske formål, som å velge øyenfarge eller høyde på barnet. Etiske retningslinjer og lover forhindrer misbruk av teknologien og sikrer at den brukes på en måte som er ansvarlig og etisk forsvarlig (1, 5).
Den europeiske foreningen for human reproduksjon og embryologi (ESHRE) gir retningslinjer for PGT som dekker tekniske standarder, kliniske indikasjoner, etiske hensyn, pasientveiledning og resultatrapportering. ESHRE oppmuntrer til systematisk rapportering av PGT-resultater for å øke innsikten i metodens effektivitet og sikkerhet. Disse retningslinjene forsøker å standardisere PGT-prosedyrene i Europa, med mål om å øke kvaliteten (6).
I Norge er PGT regulert av Bioteknologiloven, som setter strenge rammer for bruk av genetisk testing og assistert befruktning. Loven tillater bruk av PGT der en eller begge i paret er bærere av alvorlig monogen eller kromosomal arvelig sykdom, og det er stor fare for at sykdommen kan overføres til et kommende barn. Det er tillatt å bruke PGT-M, PGT-SR og PGT-HLA, mens bruk av PGT-A ikke er lov. Til tross for at PGT-A benyttes i flere europeiske land for å selektere embryoer med normalt kromosomtall, særlig i tilfeller der kvinnen har nådd en høyere reproduktiv alder, er denne metoden fortsatt ikke tillatt i Norge. Dette skyldes at PGT-A ikke faller under kriteriene for alvorlige arvelige sykdommer der loven tillater bruk av PGT. Kjønnsseleksjon i Norge er kun tillatt i tilfeller av X-bundne sykdommer, fordi disse sykdommene ofte rammer gutter mer alvorlig. De senere årene har man sett en viss liberalisering av vilkårene for hvilke pasienter som kan motta PGT-behandling, og ytterligere endringer kan komme som følge av evalueringen av Bioteknologiloven i 2025 (1-3, 7).
Historisk utvikling av PGT
PGT oppstod parallelt med fremskrittene innen assistert reproduksjonsteknologi mot slutten av det 20. århundre. PGT ble utført for første gang i 1990, for å forhindre X-bundet Duchennes muskeldystrofi ved biopsi av embryoer og PCR-analyse. På 1990-tallet ble PGT utvidet til å omfatte testing for tilstander som cystisk fibrose og kromosomale avvik, blant annet ved hjelp av fluorescens in situ hybridisering (FISH). Teknologiske fremskritt som komparativ genomhybridisering (CGH), SNP-mikromatriseteknologi (SNP array) og helgenomamplifisering (WGA) tidlig på 2000-tallet, førte til ytterligere økning i PGTs nøyaktighet og omfang. Nestegenerasjonssekvensering (NGS) revolusjonerte PGT på midten av 2010-tallet, ved å tillate detaljert undersøkelse av kromosomale og monogene sykdommer. Den nyeste teknologien vi nå ser fremvekst av er non-invasiv PGT (NIPGT), hvor man analyserer genetisk materiale fra embryoers kulturmedium. Dette vil eliminere behovet for biopsi. Prosedyren blir mer skånsom for embryoet og lettere å gjennomføre for flere (3, 5, 8-10).
Når er PGT aktuelt?
PGT tilbys til par med kjente genetiske mutasjoner som kan føre til alvorlige monogene lidelser, slik som cystisk fibrose eller Huntingtons sykdom, og for pasienter med X-bundne tilstander som Duchennes muskeldystrofi. Pasienter med balanserte kromosomale translokasjoner får også tilbud om PGT, for å forebygge spontanaborter eller genetiske lidelser på grunn av ubalanserte kromosomale avvik (figur 1). Dette er fordi balanserte translokasjoner hos foreldre gir økt risiko for ubalanserte translokasjoner hos avkom. Beslutningen om å bruke PGT tas i samråd med genetiske rådgivere og fertilitetslege, og vurderes i forhold til individuell sykehistorie, genetiske risikofaktorer, personlige preferanser og lovgivning.
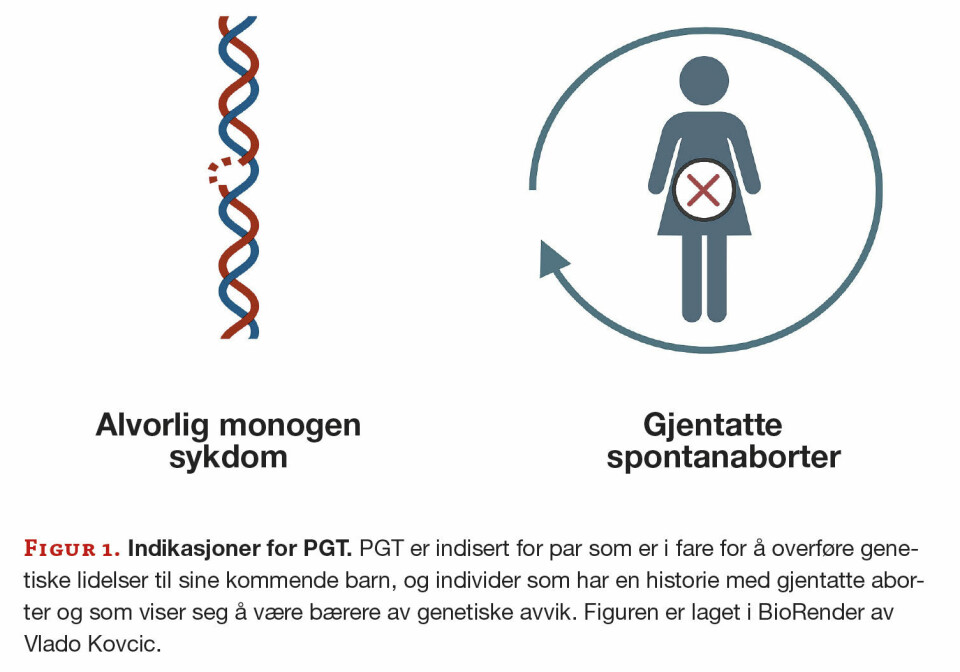
PGT kan også brukes til å velge embryoer med riktig vevstype, noe som potensielt muliggjør fødselen av et vevskompatibelt barn som kan være stamcelledonor for et søsken med alvorlig arvelig sykdom. Hvert tilfelle blir grundig vurdert med hensyn til sykdommens alvorlighetsgrad, forventet levetid, livskvalitet og tilgjengeligheten av effektive behandlinger. Denne vurderingen er avgjørende for å fastslå om sykdommen anses som alvorlig og berettiger bruk av PGT (1, 2).
PGT-prosedyre og arbeidsflyt
IVF med PGT er en av de mest omfattende og arbeidskrevende behandlingene innen assistert reproduksjon. Prosedyren involverer flere høyt spesialiserte trinn, fra ovarial stimulering til embryooverføring (figur 2).
Ovarial stimulering og befruktning
Prosessen begynner med ovarial stimulering, hvor kvinnen gjennomgår hormonell behandling for å stimulere eggstokkene til å produsere flere egg enn normalt. Eggene hentes gjennom en mindre kirurgisk prosedyre, kjent som oocyttaspirasjon. Når eggene er hentet ut, befruktes de ved hjelp av mikroinjeksjon (ICSI), hvor en enkelt sædcelle injiseres direkte inn i hvert egg.
Embryoutvikling og biopsi
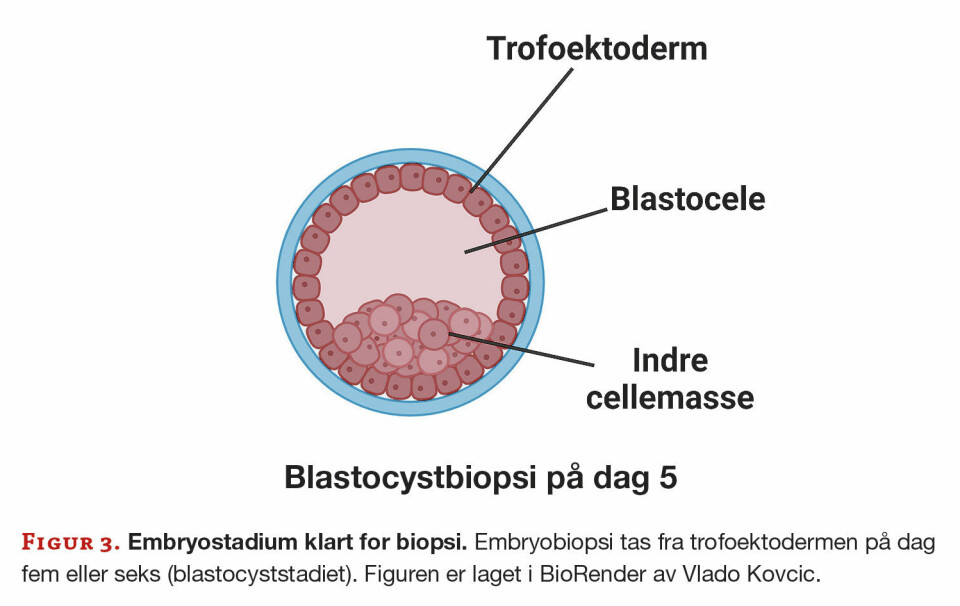
Embryoene dyrkes deretter i et kontrollert miljø i fem til seks dager, til de oppnår blastocyststadiet. I løpet av denne perioden vurderes embryoenes kvalitet og utvikling, for å sikre at de oppfyller kriteriene som er nødvendige for biopsi. På embryobiopsistadiet fjernes et lite antall celler (mellom fem og åtte) fra trofektodermen forsiktig fra embryoet (figur 3). Biopsien overføres til et rør (tubing), og sendes til genetisk analyse.
Genetisk analyse
De biopsierte cellene gjennomgår kromosomal og/eller genetisk analyse for å identifisere eventuelle avvik. Ulike teknikker brukes til analyse, avhengig av problemstilling. Eksempler på slike analyser er FISH, CGH, SNP array/karyomapping (figur 4), Short Tandem Repeats (STR) og NGS. Ved St. Olavs hospital bruker vi karyomapping (SNP array) for PGT-M, mens PGT-SR-analyse utføres med NGS.
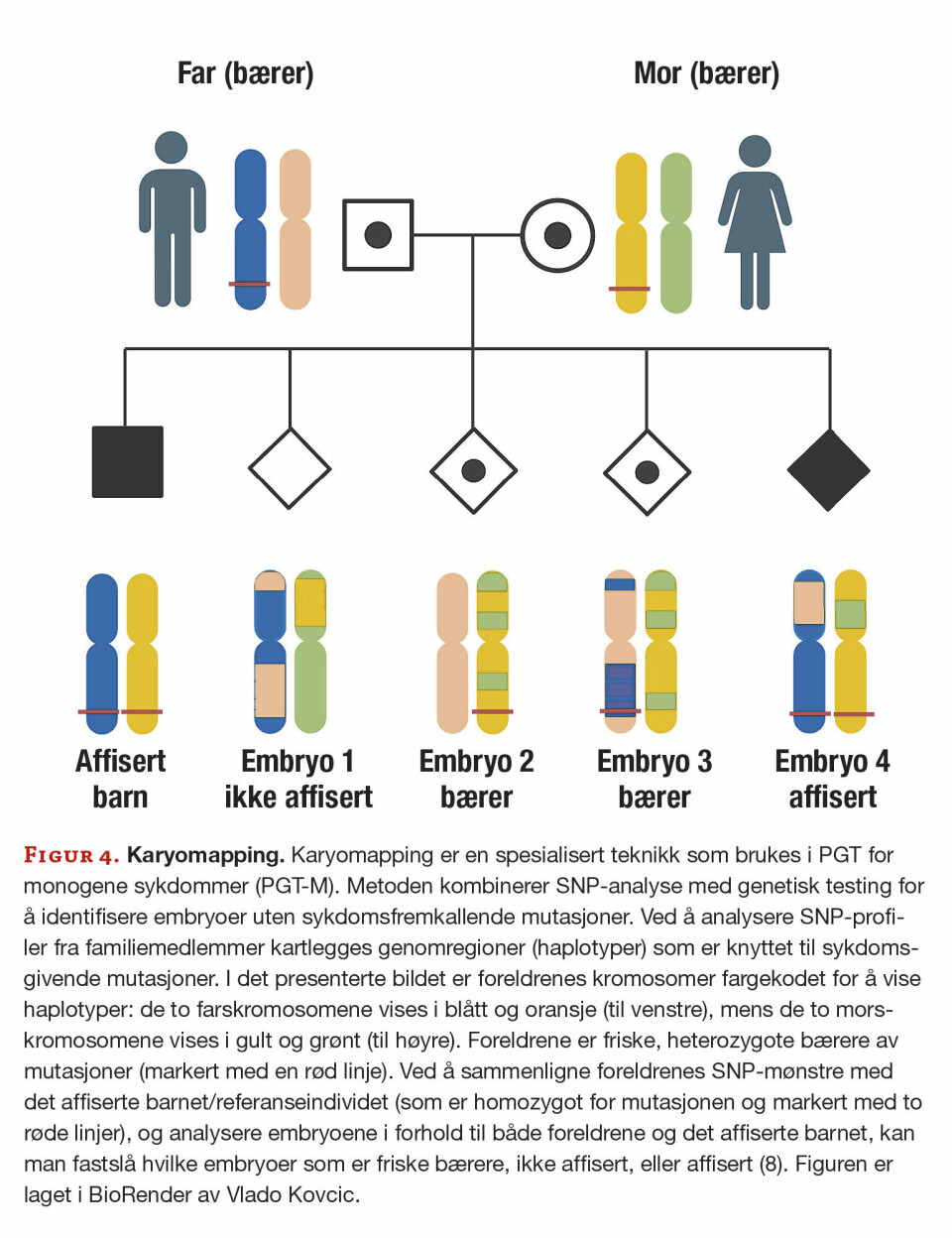
Resultatevaluering, utvalg og overføring av embryoer
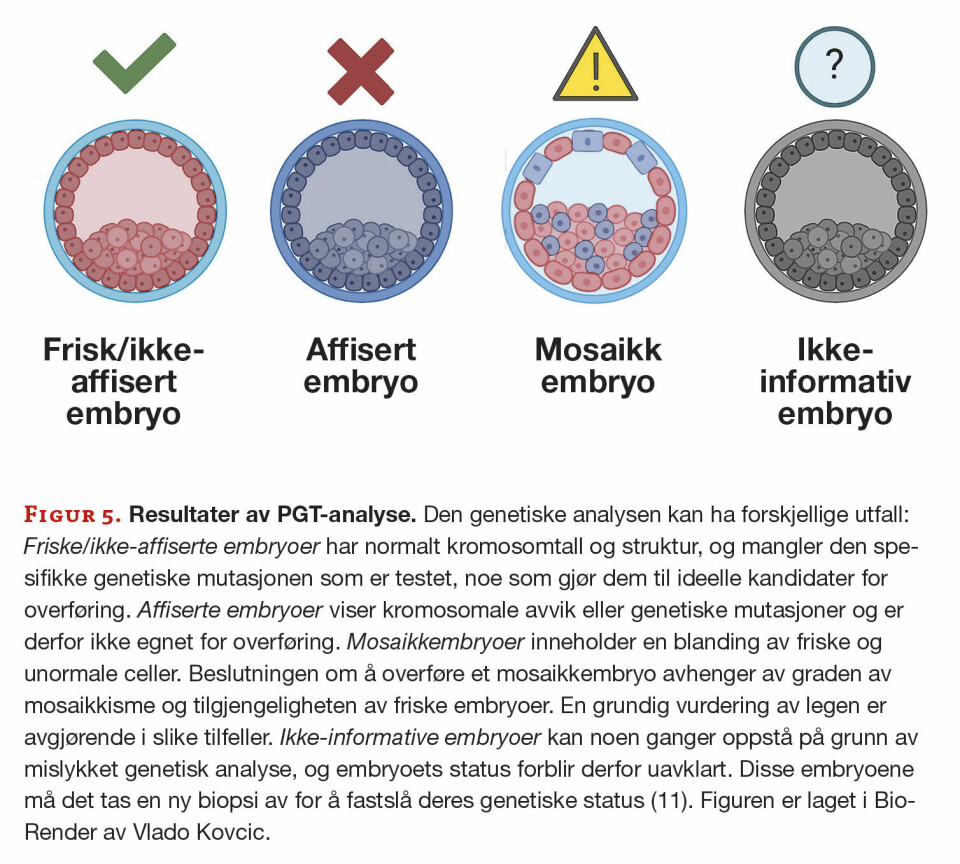
Etter genetisk analyse velges genetisk friske embryoer ut for overføring til kvinnens livmor, mens embryoer med påviste genetiske avvik destrueres. Andelen friske embryoer identifisert gjennom PGT avhenger av den spesifikke genetiske mutasjonen og arvemønsteret. Resultatene av den genetiske analysen kan identifisere "friske" embryoer, embryoer som bærer den genetiske mutasjonen, mosaikkembryoer (som betyr at de har en blanding av friske og muterte celler) eller embryoer uten informasjon (figur 5). Man setter tilbake kun ett embryo om gangen i kvinnens livmor.
Bekreftelse av graviditet
10-14 dager etter overføring av embryo tas en blodprøve eller urinprøve for å bekrefte graviditet. I uke seks eller syv utføres ultralyd for å bekrefte en klinisk graviditet (2, 8, 11).
Etiske aspekter ved PGT
Etiske utfordringer rundt PGT er komplekse og involverer pasienter, genetikere, etikere og fertilitetsleger. Et sentralt spørsmål er hva som defineres som alvorlig arvelig sykdom, fordi dette er med på å avgjøre hvilke pasienter som skal ha tilgang til teknologien. PGT reiser også samfunnsmessige etiske spørsmål om genetisk utvelgelse og potensialet for "designerbabyer", der embryoer ikke bare velges ut på grunn av helse, men også foretrukne ikke-medisinske egenskaper.
Tilgang til PGT varierer rundt omkring i verden. De høye kostnadene kan begrense tilgjengeligheten og forverre sosioøkonomiske forskjeller, og dermed føre til ulike muligheter. I Norge vil ikke dette være en stor utfordring, siden PGT er en del av det offentlige helsetilbudet og dermed tilgjengelig for de fleste (1, 12).
I tillegg kan etiske spørsmål oppstå hvis man oppdager mutasjoner som kan føre til predisposisjon for sykdom, eksempelvis BRCA1- eller BRCA2-mutasjoner som øker risikoen for bryst- og eggstokkreft. I slike tilfeller, selv om pasienten har en høyere sannsynlighet for å utvikle kreft i løpet av livet, kan de også forbli friske hele livet. Slike tilfeller reiser spørsmål om de etiske implikasjonene av å velge embryoer basert på prediktiv genetisk testing for sykdommer som kanskje aldri manifesterer seg. Pasienter skal ha muligheten til å ta egne beslutninger om hvorvidt de vil gjennomgå PGT-prosessen, basert på sine erfaringer og livssituasjon, og med genetisk veiledning (1, 13).
Et annet moment er at teknologien utvikler seg raskere enn det etikken og samfunnet er klare for. Nye teknologier, som CRISPR og NIPGT, medfører ytterligere etiske utfordringer knyttet til sikkerhet og langsiktige effekter. Kulturelle og religiøse perspektiver på PGT kan hindre valget om å gjennomgå denne prosedyren, og at man heller velger å gjennomgå svangerskapet med håp om å få et friskt barn naturlig (12, 14).
Å balansere fordelene med å forebygge genetiske sykdommer med risikoene knyttet til sosiale ulikheter, psykologiske virkninger og etiske dilemmaer krever robuste etiske standarder, informert samtykkepraksis, rettferdig tilgang og løpende dialog blant alle involverte parter. Etikken i samfunnet, eller hva samfunnet er villig til å akseptere på et gitt tidspunkt, er i konstant endring: det som ikke er akseptert i dag, kan være fullt akseptert om fem år. Derfor må lovverket holde tritt med den raske utviklingen (1, 12).
Fremtidsperspektiver for PGT
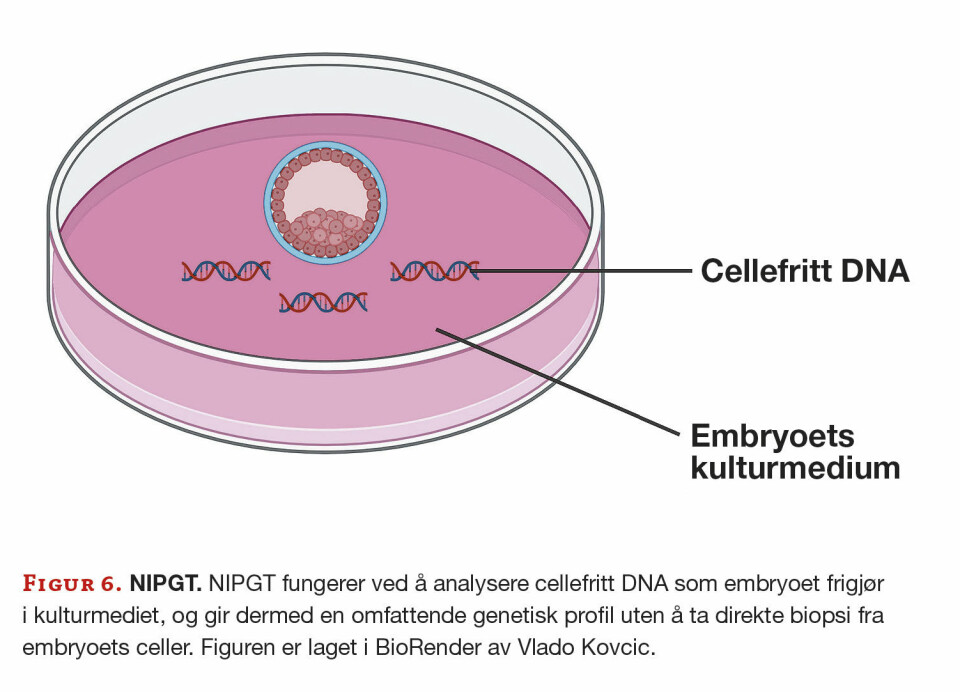
Fremtiden for PGT ser lovende ut, med potensielle fremskritt innen nøyaktighet og anvendelighet. NIPGT er en ny teknologi som kan eliminere behovet for embryobiopsi ved å analysere genetisk materiale fra embryoets kulturmedium. NIPGT fungerer ved å detektere cellefritt DNA som embryoet frigjør i kulturmediet, og gir dermed en omfattende genetisk profil uten å ta biopsi (figur 6). Dette reduserer risikoen for skade på embryoet, noe som gjør prosedyren tryggere og mindre invasiv. NIPGT kan også potensielt håndtere problemet med mosaikkembryoer, som inneholder en blanding av normale og unormale celler. Tradisjonell PGT kan overse slike mosaikker eller gi tvetydige resultater, men NIPGT kan gi et mer helhetlig bilde av embryoets genetiske sammensetning ved å analysere DNA frigjort fra hele embryoet, og dermed potensielt øke nøyaktigheten i diagnosen. Videre forskning er imidlertid nødvendig på dette feltet (9).
Fremskritt innen NGS-teknologi forventes å forbedre presisjonen og utvide det detekterbare spekteret av genetiske avvik. CRISPR, kjent for genredigering, gjør det mulig å endre DNA-et til embryoer, noe som kan tillate korrigering av "syke" embryoer og dermed potensielt eliminere genetiske problemer. CRISPR er foreløpig ikke brukt i klinisk praksis, men det vil sannsynligvis bli en generell praksis i fremtiden. Man kan komme til å nå et punkt hvor det anses som uetisk å destruere et påvirket embryo, når man i stedet kan modifisere det og korrigere sykdommen (14).
Konklusjon
PGT har gjort betydelige fremskritt siden den første bruken på 1990-tallet og tilbyr i dag mange fordeler innen assistert befruktning. Teknikken muliggjør tidlig påvisning av genetiske lidelser i embryoer før implantasjon, og gir fremtidige foreldre muligheten til å velge genetisk friske embryoer under IVF. Dette kan potensielt forhindre fødselen av barn med alvorlige arvelige sykdommer, samtidig som det øker sjansen for vellykket implantasjon og reduserer risikoen for spontanabort grunnet kromosomale avvik.
Likevel står PGT overfor utfordringer som krever nøye vurdering. Tekniske begrensninger kan medføre falskt positive eller negative resultater, noe som kan påføre emosjonell belastning og gjøre beslutningsprosessen vanskelig for foreldrene. Etiske dilemmaer, som valget om å selektere sykdomsfrie embryoer og destruksjon av andre embryoer, må også tas på alvor. Disse komplekse problemstillingene krever både etisk vurdering og grundig genetisk veiledning for å sikre ansvarlig bruk av teknologien (12).
Med de kontinuerlige fremskrittene innen genetisk testing og teknologi har PGT et stort potensial for ytterligere forbedringer i nøyaktighet og anvendelse. Fremtiden for PGT er lovende, og det vil fortsette å være et uvurderlig verktøy innen reproduktiv medisin, så lenge etiske hensyn blir ivaretatt.

























