FAG i praksis

Resistensbestämning med EUCASTs lappdiffusionsmetod – vad har hänt på två år?
Fram till 2009 användes flera olika lappdiffusionsmetoder på skandinaviska mikrobiologiska laboratorier.I dag använder de flesta laboratorier i Skandinavien EUCASTs lappdiffusionsmetod.
Resistensbestämning av bakterier är en stor del av en mikrobiologs vardag och utförs i stor utsträckning med hjälp av lappdiffusion i rutindiagnostik.
Lappdiffusion innebär att en papperslapp indränkt i antibiotika placeras på en agarplatta där en mikroorganism (bakterie) är utstruken. Antibiotika diffunderar ut i agarn och bildar en hämningszon som är fri från växt av bakterier. Genom att mäta hämningszonens storlek kan man med hjälp av tolkningsregler, så kallade brytpunkter, bestämma om en organism är känslig eller resistent mot ett visst antibiotikum (figur 1).

Gemensam europeisk metod
European Committee on Antimicobial Susceptibility Testing (EUCAST) är en brytpunktskommitté som under många år har arbetat med att utforma gemensamma brytpunkter för europeiska länder. ”Minimum Inhibitory Concentration” (MIC) är referensmetod för resistensbestämning och under 2002-2008 arbetade EUCAST med att ta fram gemensamma MIC-brytpunkter.
Under 2008 beslutade EUCAST att utveckla en standardiserad lappdiffusionsmetod med zonbrytpunkter som korrelerar mot de gemensamma MIC-brytpunkterna och det bestämdes att metoden skulle utvecklas på Klinisk mikrobiologi i Växjö i södra Sverige. Att utvecklingen blev förlagd till laboratoriet i Växjö beror dels på att vår klinikchef Gunnar Kahlmeter är ordförande i EUCAST, och dels på att laboratoriet är svenskt referenslaboratorium för resistensbestämning.
Flera laboratorier i Europa hade vid den här tidpunkten uttryckt ett behov av en gemensam standardiserad metod i lappdiffusion. Det finns flera fördelar med en gemensam metod, framför allt att man kan jämföra resultat från olika laboratorier och länder och därmed följa resistensutveckling på ett bättre sätt.
Mueller Hinton-agar
Vissa grundläggande parametrar var redan bestämda när vi började utvecklingsarbetet, till exempel att vi skulle använda Mueller Hinton-agar med konfluerande (heltäckande) växt. En av de viktigaste anledningarna till det var att dessa parametrar redan används i stora delar av världen och rekommenderas av CLSI, den amerikanska motsvarigheten till EUCAST.
Genom att ha en gemensam metodik med CLSI kan vi jämföra resultat från de båda systemen och båda organisationerna kan dra nytta av detta. EUCASTs lappdiffusionsmetod är på vissa områden identisk med den amerikanska metoden, men det finns också viktiga skillnader. Medium för krävande organismer (se nedan), styrka på antibiotikalapparna och tolkningsreglerna (brytpunkterna) skiljer sig åt i olika grad mellan metoderna.
Några europeiska länder har publicerat egna lappdiffusionsmetoder, bland annat Frankrike, Storbritannien och tidigare även Sverige. Vilken agar som används och växtens tjocklek varierar mellan metoderna och alla har sina för- och nackdelar. Det är ofta lättare att läsa zonerna på plattor med tunnare (semikonfluerande) växt, men man kan missa viktiga resistenser. I EUCAST-metoden är bakterielösningen standardiserad och motsvarar en viss grumlighet, vilken man kan mäta med enkla instrument, och lösningen stryks sedan ut på agarplattan med en bomullspinne. I vissa metoder hälls bakterielösningen ut över plattan, vilket resulterar i jämnare växt än om man använder en bomullspinne, men det är svårare att standardisera resultatet. När man använder EUCAST-metoden kan man inte hälla ut bakterielösningen över plattan eftersom det resulterar i för tjock växt, vilket påverkar hämningszonernas storlek och kan resultera i feltolkade resultat.
Utveckling av nya metoden
Under hösten 2008 började vi göra preliminära tester där vi utvärderade Mueller Hinton-agar från olika leverantörer, kontrollerade växt av vanligt förekommande organismer samt utvecklade ett medium för organismer som kräver mer näring för att växa bra, så kallade krävande organismer (MH-F, Mueller Hinton Fastidious). Ett viktigt delmål var att ta fram ett substrat som kunde användas för flertalet krävande organismer, till exempel streptokocker och Haemophilus influenzae, och att inte behöva använda separata substrat till dessa organismer. Vi tog även fram data för att kunna sätta preliminära brytpunkter för vanligt förekommande organismer. I februari 2009 var det dags för oss i Växjö att som första laboratorium byta till EUCAST-metoden. Det var några hektiska veckor före och efter övergången, men i efterhand tyckte de flesta att det hade gått smidigare än väntat.
Brytpunktstabell
Under hela 2009 resistensbestämde vi vanligt förekommande organismer mot ett stort antal antibiotika på vårt laboratorium. Även antibiotika som normalt inte används på skandinaviska laboratorier skulle ju få brytpunkter. De biomedicinska analytiker (bioingeniører) som arbetar i vår rutinverksamhet fick läsa många extra zoner under den här perioden.
I slutet av 2009 hade vi tillsammans samlat in tillräckligt mycket data för att kunna sätta brytpunkter för vanligt förekommande organismer. I slutet av 2009 publicerade vi metodbeskrivningar och riktlinjer för tolkning av resultaten, så kallade brytpunktstabeller, på EUCASTs hemsida (www.eucast.org). Under 2010 publicerades även en skandinavisk version av tabellen översatt till svenska och AFA (Arbeidsgruppen for antibiotikaspørsmål) baserade även sin brytpunktstabell på EUCAST-tabellen. Från och med 2012 finns det en gemensam skandinavisk brytpunktstabell med både svensk och norsk översättning (www.srga.org).
Övergång till nya metoden
Under hösten 2009 började vi utbilda laboratoriepersonal i den nya metodiken. I de flesta fall blev det utbildningar som sträckte sig över två dagar med både teoretiska genomgångar och praktiska moment. I oktober, november och december 2009 höll vi tre utbildningar för representanter för alla svenska laboratorier på Klinisk mikrobiologi i Växjö. Vid dessa tillfällen deltog även representanter från Danmark och Norge, vilka sedan hjälpte oss att anordna liknande utbildningar i Köpenhamn, Tromsø och Oslo under 2009 och 2010. För oss var det trevligt både att få återkomma till Tromsø, där vi hade varit på konferens hösten 2009, och att få träffa alla bioingeniører från de norska laboratorierna.
Vi fick stor hjälp av Bjørg Haldorsen, Astrid Lia och Marit Vattøy som hjälpte oss med alla praktiska detaljer vid utbildningarna i Norge.
Under 2009 och 2010 höll vi totalt nio utbildningar med teori och praktik i Danmark, Finland, Norge och Sverige. Vi hade stor nytta av att ha genomfört övergången till den nya metoden på vårt eget laboratorium, och kunde på så sätt dela våra erfarenheter både gällande med- och motgångar.
Skandinavien var först
De skandinaviska länderna var först med att gå över till EUCASTs lappdiffusionsmetod, vilket vi kan vara stolta över. Enligt ett frågeformulär som vi skickade ut i april 2010 planerade 12 av 14 laboratorier i Norge att byta till EUCASTs metod under 2010.
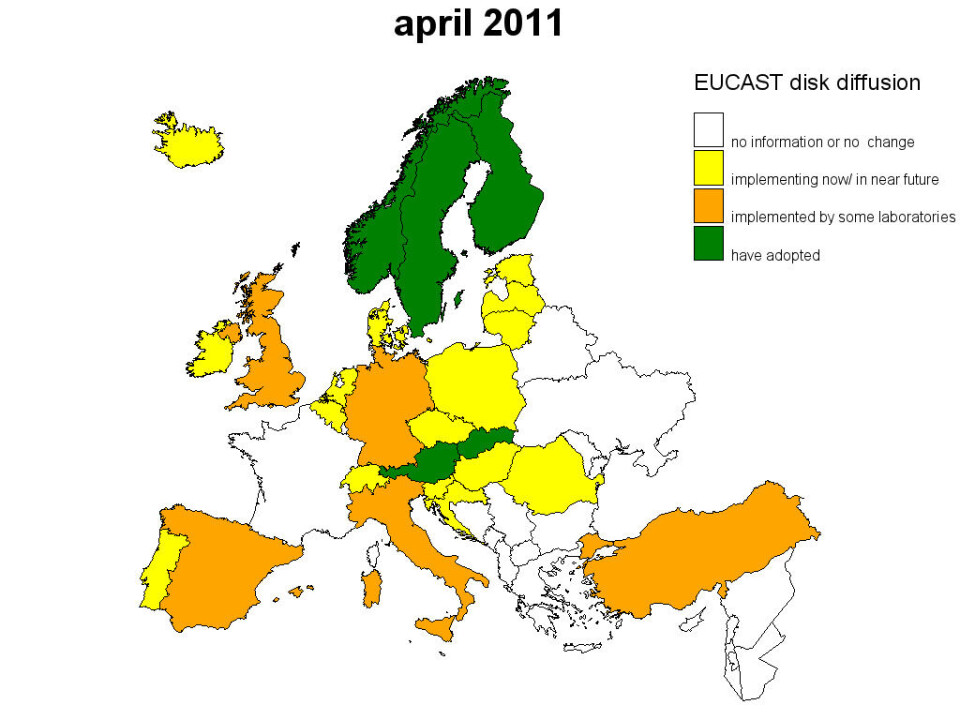
I april 2011 skickade EUCAST ut ett motsvarande frågeformulär till laboratorier i hela Europa. EUCASTs MIC-brytpunkter användes då i 17 europeiska länder och ytterligare 18 länder planerade en övergång inom den närmsta framtiden. Vid samma tidpunkt använde 12 europeiska länder helt eller delvis EUCASTs lappdiffusionsmetod och ytterligare 16 länder planerade en övergång (Figur 2). Det finns även ett stort intresse för metoden utanför Europa, bland annat i Australien och Brasilien.
Bättre än väntat
I samband med utbildningarna fick vi många frågor via mail och telefon och vi skapade efter hand ett dokument med ”Frequently Asked Questions” som finns tillgängligt på EUCASTs hemsida (www.eucast.org). Många frågor återkom från flera laboratorier och vissa moment har upplevts som svåra på många laboratorier, bland annat avläsning av zoner för specifika art-/antibiotikakombinationer. I frågeformuläret vi skickade ut i april 2010 svarade dock 12 av 16 laboratorier i Danmark, Sverige och Norge att övergången hade gått bra och de flesta upplevde att det gick bättre än väntat. Vissa laboratorier tyckte att man hade haft en del problem i början, men att det fungerade bra efter en tids arbete med nya metoden.
Vid övergången till EUCASTs lappdiffusionsmetod blev det för många laboratorier samtidigt en skärpning av metodiken. Vi kunde tydligt se på vårt eget laboratorium att de riktlinjer som rekommenderades i den metod vi använde tidigare inte följdes, utan att man hade gjort avvikelser på flera ställen.
Support till laboratorier
En stor del av vårt nuvarande arbete innebär att svara på frågor och ge support till laboratorier, framför allt de som håller på att införa metoden. Avläsning av zoner är ett område som vi fortfarande får mycket frågor om. I flera fall har vi skickat plattor från vår produktion till de laboratorier som har haft problem med avläsning av zoner eller med zonstorleken på kvalitetskontrollstammar. Vi har även tagit emot plattor från många laboratorier och testat dem i Växjö. Det har visat sig vara ett effektivt sätt att felsöka och i flera fall har vi hittat enkla lösningar på problemet, som till exempel att tjockleken på agarn har varit för tunn eller för tjock. Ett bra sätt att aktualisera problematik vid zonavläsning och upprätthålla kompetensen på laboratoriet är att regelbundet genomföra avläsningsövningar där all laboratoriepersonal läser zoner från samma platta.
Fortsatt diskussion
Nu har laboratorierna i de skandinaviska länderna använt EUCASTs lappdiffusionsmetod under en ganska lång period och antalet frågor från dessa länder har minskat med tiden. För tillfället får vi mest frågor från Island, Irland, Nederländerna och Tyskland, men det finns alltid möjlighet för de skandinaviska länderna att fortsätta ställa frågor. På den årliga workshopen i resistensbestämning för skandinaviska laboratorier som hålls i Göteborg ges många tillfällen för fortsatt diskussion om metoden och dess utveckling.
Till workshopen brukar vi samla in data och frågor och diskussionerna brukar vara givande. Vi hoppas på att kunna fortsätta dessa diskussioner och på så sätt fånga upp aktuella problemställningar under många år framöver. Nästa workshop är inplanerad 30-31 maj 2012.
Fortsatt arbete
Sedan den första brytpunktstabellen publicerades i slutet av 2009, har vi som arbetar med utvecklingen av EUCASTs lappdiffusionsmetod fortsatt vårt arbete med att ta fram underlag för att sätta nya brytpunkter, samt att justera satta brytpunkter genom att korrelera hämningszoner till motsvarande MIC-värden. Efter att ha validerat och justerat zonbrytpunkter för vanligt förekommande organismer har vi fortsatt med att ta fram data för övriga organismer, till exempel Pasteurella multocida, Listeria monocytogenes och Campylobacter jejuni. Under 2012 kommer vi bland annat att arbeta med att ta fram brytpunkter för Yersinia enterocolitica och Corynebacterium spp. Trots att vi nu har kommit en lång bit på vägen så finns det fortfarande mycket arbete kvar att göra!
För frågor och ytterligare information, kontakta: erika.matuschek@ltkronoberg.se























