FAG Essay
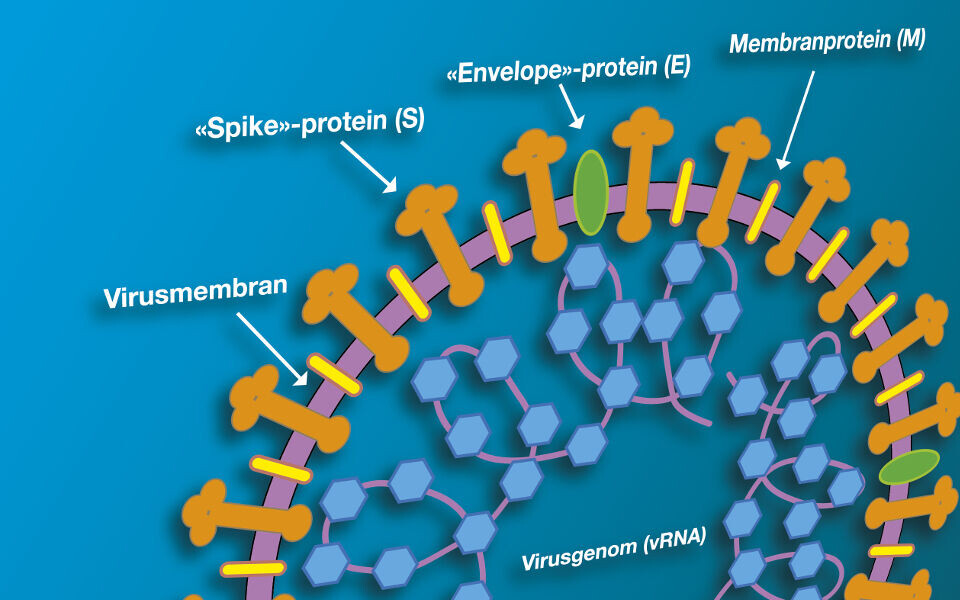
SARS-CoV-2; Mutasjoner og varianter
Vi har i den siste tiden sett hvordan delta-varianten av SARS-CoV-2 har fosset frem og nå er den dominerende varianten av viruset på de fleste kontinenter. Hva er disse variantene og hvordan oppstår de?
SARS-CoV-2; Mutasjoner og varianter.pdf(306 KB)
I desember 2019 kom de første rapporter om et utbrudd i Wuhan-provinsen i Kina, forårsaket av et nytt og ukjent virus. Det viste seg å være et koronavirus som var årsaken til det som har utviklet seg til å bli den mest alvorlige pandemien i nyere tid. Fire koronavirus har sirkulert i befolkningen gjennom mange år, men de har fått lite oppmerksomhet siden de har gitt svært milde forkjølelsessymptomer.
I 2002-2004 var det et utbrudd med begrenset omfang av et koronavirus i Sørøst-Kina og Hong Kong, som ga kraftige respiratoriske symptomer og fikk navnet SARS (Severe Acute Respiratory Syndrome) virus.
I 2012 fikk vi et nytt utbrudd på den arabiske halvøy av et annet koronavirus, det såkalte MERS-viruset (Middle East Respiratory Syndrome), som fortsatt har sporadiske utbrudd. I alle disse tilfellene kommer virusene fra dyr som smitter til mennesker (zoonose). Det viser seg at vi kan finne virus i infiserte flaggermus, som er genetisk svært like de smittestoffene som vi nå har funnet hos mennesker.
Varianter av SARS-CoV-2
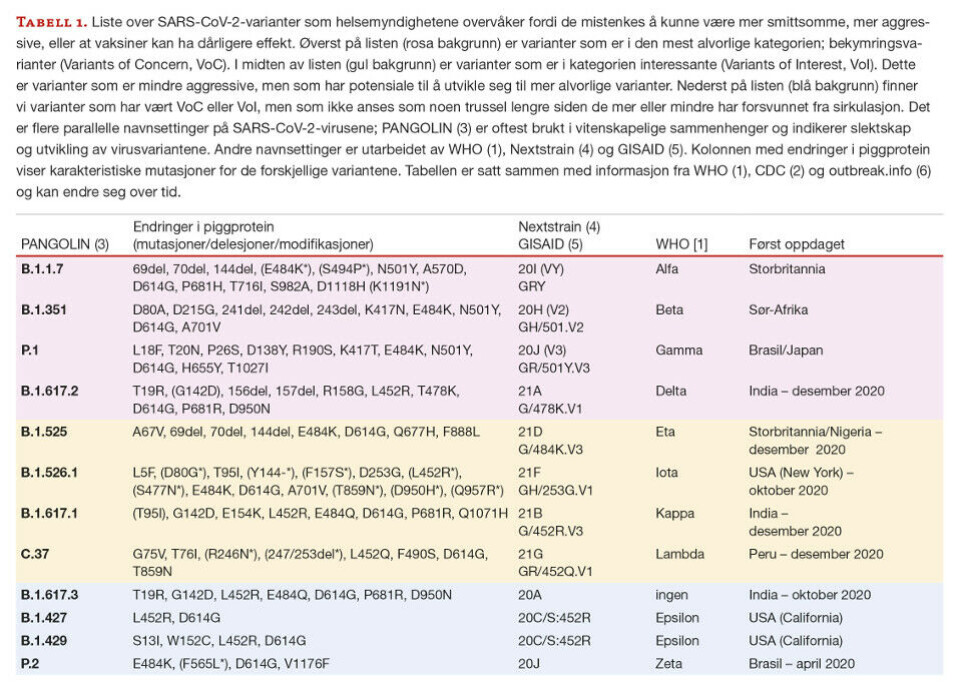
SARS-CoV-2 er i konstant forandring og nye varianter oppstår hele tiden. En variant er ikke et enkelt virus, men en samling av forskjellige virus som har samme slektsmessige opphav og liknende mutasjonsmønster. Noen varianter kan potensielt ha endrede egenskaper, slik som å være mer aggressive eller mer smittsomme enn det opprinnelige viruset. Verdens helseorganisasjon (WHO) og andre helseorganisasjoner har kalt varianter som man antar kan være mer aggressive eller smittsomme for bekymringsvarianter (variant of concern,VoC) eller interessante varianter (variant of interest, VoI) (Tabell 1) (1, 2, 7, 8). VoI er varianter som har mutasjoner som kan ha betydning for økt spredning i befolkningen og som potensielt kan utvikle seg til mer aggressive former. VoC er mutanter som har endret seg og kan være mer smittsomme ved at viruset replikerer raskere og produserer flere virus, unnslipper allerede etablert immunforsvar etter tidligere infeksjon/vaksinasjon eller kan gi kraftigere symptomer og sykdom.
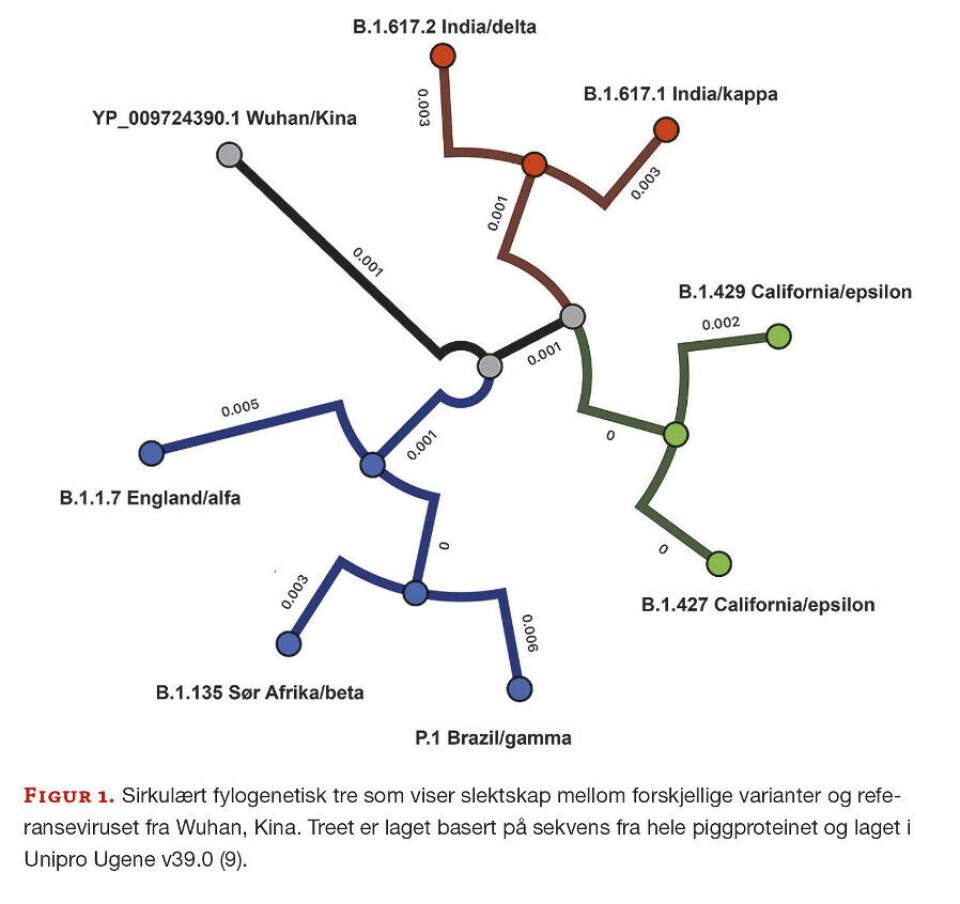
Det er rask spredning av de forskjellige virusvariantene. Det som vi kaller «den brasilianske varianten» kan ha spredd seg til alle kontinenter før den ble oppdaget i Brasil. Navnet gjenspeiler ikke hvor virusvarianten oppsto, men hvor den først ble oppdaget. De forskjellige variantene gir oss ny og viktig kunnskap, og siden virusene er i stadig forandring gir de fra seg et spor. Med avanserte bioinformatiske analyser er vi i stand til å avlese dette sporet og kan bestemme hvor viruset kommer fra og hvordan det har spredt seg i en populasjon (Figur 1). Det er derfor viktig å holde oversikt over varianter som sirkulerer i miljøet. Når nye varianter oppstår kan de ta over og dominere i geografiske områder, det kan også føre til at tidligere dominerende varianter forsvinner for godt. Det har vi sett flere eksempler på.
I mange land bygges nå flokkimmuniteten gradvis opp ved at mange blir vaksinert eller har gjennomgått smitte. Så langt er ingen land kommet til det stadiet at de har oppnådd fullstendig flokkimmunitet. Vi ser at landene med høyest vaksinedekning merker den positive effekten ved langt færre alvorlig syke og døde i forhold til antall smittede. Ved økende vaksinasjonsdekning og økt beskyttelse i befolkningen vil SARS-CoV-2 møte motstand og spredning vil begrenses. Dette vil igjen føre til et seleksjonspress på viruset, og det vil prøve å endre seg slik at det unngår å bli gjenkjent og stoppet av det ervervete immunsystemet. Eksperimentelt ser vi at vaksinene som nå vanligvis er brukt gir noe redusert beskyttelse mot den indiske varianten (delta, B.1.617.2). Dette blir støttet av flere rapporter hvor fullvaksinerte er blitt smittet med denne varianten. Vi ser også nå at nye VoC/VoI-varianter kommer raskere enn før.
Mutasjoner i piggproteinet
Arvematerialet til SARS-CoV-2 består av en RNA-tråd som er over 29 000 nukleotider lang, og inneholder en rekke gener som koder for til nå 38 kjente proteiner. SARS-CoV-2 muterer kontinuerlig, og mutasjonene akkumuleres i alle deler av virusets gener. Når det blir mange mutasjoner kan det medføre at de fenotypiske egenskapene til viruset endres, og den regnes da som en ny variant.
Vi finner mange mutasjoner i nsp-3-genet, som er involvert i virusreplikasjon, og 3cl-pro-genet, som koder for en proteinase, men de aller fleste mutasjonene finner vi i S-genet. Dette genet på cirka 4000 nukleotider koder for piggproteinet (spike protein, surface glucoprotein. S-protein), som er bygget opp av 1273 aminosyrer (Figur 2).
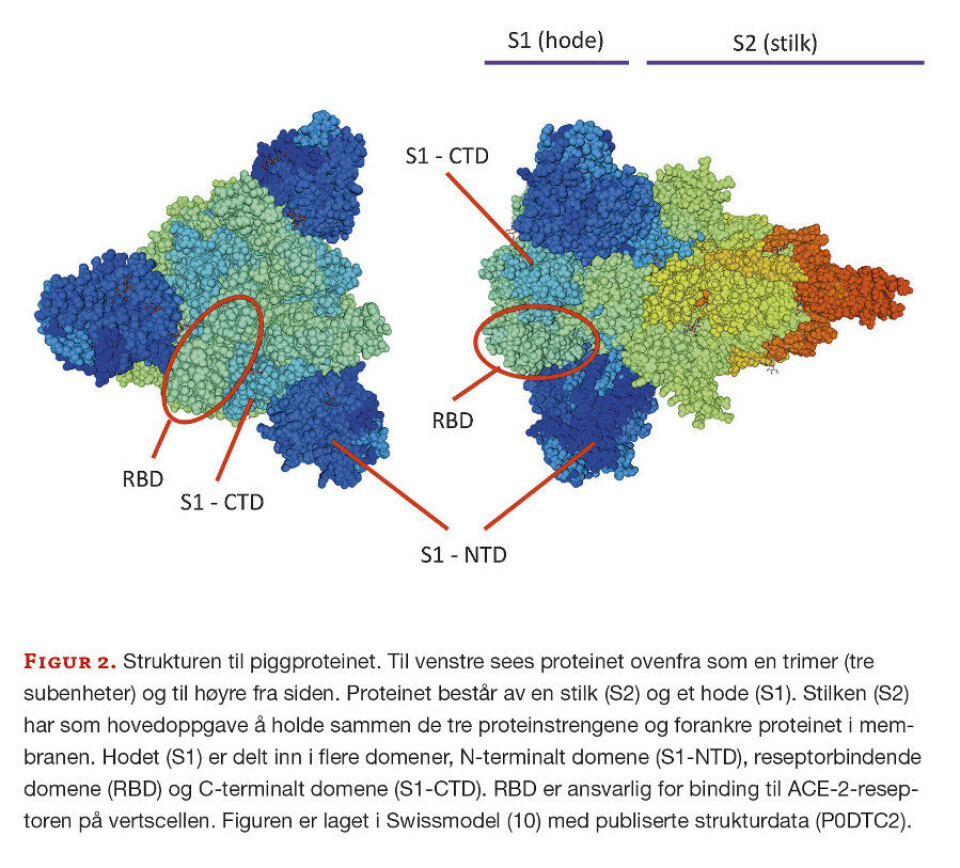
Proteinene står ut som pigger på overflaten av virionet (= viruset i fri form), og er ansvarlig for at viruset fester seg til cellene i slimhinnene hvor viruset først infiserer. På piggproteinet er det spesielt ett område som er utsatt for mutasjoner; det reseptorbindende domene (RBD) i posisjon 319-541. Det er denne delen av piggproteinet som binder til Angiotensin-converting enzyme 2 (ACE-2)-reseptoren på vertscellen (Figur 2). Mutasjonene som per i dag brukes til å identifisere og differensiere mellom bekymringsvariantene ligger i aminosyreposisjon 417, 452, 478, 484 og 501 (Figur 3). Eksempelvis ligger aminosyren i posisjon 484 helt ytterst på piggproteinet og er direkte koblet til ACE-2.
Navnsetting
Det er utviklet flere nomenklaturregler (navnesystemer) for SARS-CoV-2-variantene (Tabell 1). Populært sett har stammene fått navn etter hvor de er først oppdaget, for eksempel de britiske, brasilianske, sørafrikanske og indiske variantene. Systemet som WHO har introdusert er basert på greske bokstaver (1), men dette systemet gir ikke den oppløsningen og detaljene som er nødvendig for epidemiologer og forskere. Derfor brukes det forskerbaserte PANGOLIN (Phylogenetic Assignment of Named Global Outbreak Lineages)-systemet (3). PANGOLIN er primært et program som analyserer SARS-CoV-2-sekvenser og sammenlikner med andre kjente sekvenser og plasserer dette i tid og rom (5). Her får virusstammene/variantene en kode som består av en bokstav og én til tre tall, separert med punktum. Koden angir plassering i et fylogenetisk tre basert på slektskap og hvor varianten er isolert (Figur 1).
Et eksempel; en av de norske variantene har fått PANGOLIN kode B.1.1.333, en variant som sirkulerte i Norge fra midten av november 2020 til slutten av mars 2021. Det finnes flere andre norske varianter som; B.1.1.451, B.1.36.21, B.1.242, og K.3 (B.1.1.277). Felles for B.1, som er den europeiske linjen, er at de har følgende mutasjoner (SNPer); 28881GA, 28882GA og 28883GC. Ikke alle variantene har karakteristiske mutasjoner i S-genet, men kan ha diskrete mutasjoner i andre gener. I tillegg til å ha oversikt over mutasjoner, er det viktig å vite hvor og når de forskjellige variantene sirkulerte. Mange av variantene kan ha forsvunnet fra sirkulasjon ved at andre varianter dominerer og tar over, mens andre kan ha overlevd fordi forskere har tatt vare på dem i laboratorier. Grovt sett kan man si at linje A er roten til pandemien og mange isolater i denne gruppen kommer fra Kina. A.1 er en hovedlinje som hovedsakelig er funnet i USA, B.1 er en europeisk linje og C.1 er hovedsakelig afrikansk.
Identifisering av varianter
Her i Norge blir en del av de positive PCR-prøvene screenet for varianter på de enkelte prøvelaboratorier. Et utvalg av prøvene blir også sendt til FHI for fullsekvensering og detaljert karakterisering. Resultater blir også delt med GISAID (Global Initiative on Sharing Avian Influenza Data)-databasen (11).
Det er utviklet en mengde prinsipielt forskjellige metoder for å identifisere varianter av SARS-CoV-2 (12, 13), og de baserer seg på å detektere forskjeller i virusgenene. Foreløpig finnes det ikke tilgjengelig godkjente immunologiske tester, men det kan komme med tiden. Valg av analysemetode i ulike laboratorier baseres på faktorer som etablert metodikk, tilgjengelig utstyr, integrering i rutinen, praktiske, økonomiske og personellmessige ressurser.
Det finnes en rekke metoder og automatisert utstyr for sekvensering av både DNA og RNA. For en grov tilnærming er det tilstrekkelig å sekvensere deler av gensekvensen som koder for RBD. Mutasjoner i aminosyreposisjonene 417, 452, 478, 484 og 501 kan brukes til å differensiere mellom VoC (Figur 3).
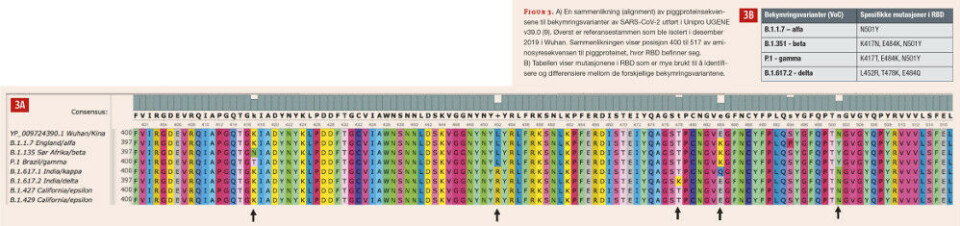
Ønsker en mer nøyaktig identifikasjon må en gjerne sekvensere hele virusgenomet og legge sekvensen inn i PANGOLIN, som vil sammenlikne sekvensen mot alle publiserte sekvenser i GISAID-databasen (3, 5). Man kan også gjøre en genotyping hvor man undersøker flere mutasjoner samtidig i en reaksjon, f.eks. ved multipleks-PCR fragmentanalyse og påfølgende kapillærelektroforese (14). Lengden på PCR-fragmentene brukes til å identifisere variantene. En annen SNP-genotypingsmetode er utviklet ved at man benytter en blanding av mutasjonsspesifikke primere i PCR-reaksjonen (15). Disse primerne er merket med fluorescerende reportere som detekteres ved forskjellige bølgelengder. Den kanskje vanligste metoden som brukes som mutasjonsscreening er sanntids-PCR med påfølgende smeltekurveanalyse (16,17). Denne metoden er det enklere å integrere i en rutineanalyse, siden virusprøvene oftest blir analysert ved revers transkriptase PCR. Ved å kjøre asymmetrisk PCR (det vil si at ulik konsentrasjon av PCR-primerne fører til ulik mengde av de to amplifiserte komplementære trådene) på de positive PCR-prøvene og benytte spesielt designede primere og prober, vil mutasjoner i amplikonet kunne påvises ved endret smeltetemperatur.
Oppsummering
Aldri i nyere historie har et virus som SARS-CoV-2 hatt så stor påvirkning på økonomi og dagligdagse operasjoner. På kort sikt ble mye stengt ned og nå ett og halvt år senere begynner samfunnet å forsiktig åpne opp igjen. Det er forbundet med stor fare hvis viruset får herje fritt i samfunnet. Kombinasjon av mye sirkulerende virus og delvis beskyttelse kan føre til et sterkt seleksjonspress som kan drive viruset til å endre seg i en uønsket retning.
Koronaviruset har hele tiden vært svært smittsomt og kan gi alvorlige komplikasjoner i utsatte grupper, uansett hvilken variant en har blitt smittet med. Spesielt bør unge voksne være forsiktig, for selv om de fleste får milde sykdomssymptomer så er det mange i den gruppen som sliter med langtidsettervirkninger. Alle som ikke har særlig grunn, bør ta vaksinen når de får tilbud om det.
Hva har vi lært av covid-19-pandemien? Det viktigste er å raskt hindre spredning ved å begrense bevegelse og sosial kontakt, drive smittesporing og isolere smitte (TISK). Å lette på begrensninger av økonomiske grunner før en har full kontroll har vist seg å være en dårlig strategi. Selv om vaksineproduksjonen kom relativt raskt i gang etter pandemien ble erklært, har tilgang til nok vaksiner vært en begrensende faktor for å nå ønsket vaksinedekningsmål. Ved svineinfluensapandemien i 2009 ble ikke samfunnet lukket ned og da massevaksinering startet i oktober samme år gikk det ikke mange månedene før en stor del av befolkningen ble vaksinert. Nå er det slik at ingen pandemi er helt lik, men kanskje bør det offentlige få på plass produksjonsutstyr og andre ressurser som gjør oss mer forberedt når en ny pandemi bryter ut.

























