Føtal/neonatal alloimmun trombocytopeni (FNAIT) er en tilstand hvor blodplatene til fosteret eller den nyfødte ødelegges av maternelle platereaktive antistoffer som krysser placenta under graviditeten (1). FNAIT kan være livstruende for barnet som rammes, og fordi svangerskapsomsorgen ikke inkluderer screening med tanke på platereaktive antistoffer, oppdages tilstanden oftest tilfeldig etter fødselen (2).
FNAIT er den hyppigste enkeltårsaken til alvorlig trombocytopeni hos nyfødte (3), og bør alltid mistenkes dersom det fødes barn med trombocytopeni uten annen forklaring. Diagnostiseringen skjer ved å påvise alloantistoffer av IgG-klasse hos mor, som reagerer med antigener uttrykt på barnets blodplater.
Antigenuforlikelighet mellom mor, far og barn, tilsvarende antistoffets spesifisitet, støtter diagnosen (1). Nasjonalt referanselaboratorium for avansert blodplateimmunologi på UNN i Tromsø utfører alle laboratorieanalyser som er nødvendig for å stille en FNAIT-diagnose. Laboratoriet mottar prøver fra hele landet til slik utredning.
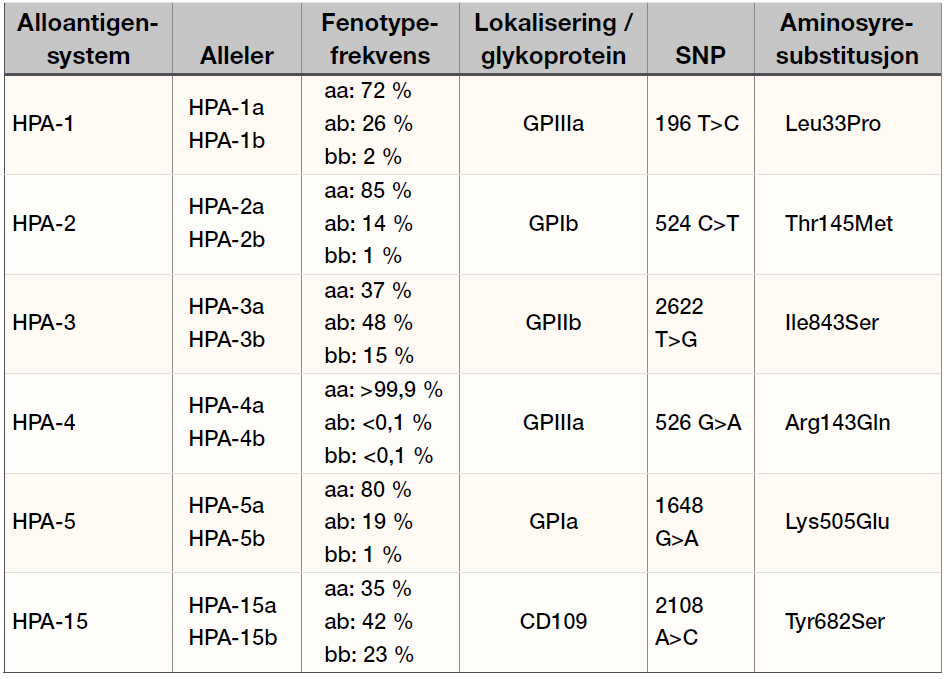
Blodplateantigener
Humane blodplater uttrykker mange unike blodplateantigener (HPA) lokalisert på ulike glykoproteiner i cellemembranen. Det er så langt beskrevet mer enn 24 ulike HPA-varianter, de klinisk viktigste med tanke på FNAIT er oppsummert i tabell 1. Blodplateantigenene er organisert i biallele systemer, der allelet med høyest frekvens betegnes ”a” mens allelet med lavest frekvens betegnes ”b”. Man er enten homozygot (aa eller bb) eller heterozygot (ab) i hvert av HPA-systemene. Forskjellen mellom a- og b-allelet defineres av en enkelt aminosyresubstitusjon forårsaket av en SNP (single nucleotide polymorfism) i genet som koder for det aktuelle glykoproteinet (4).
Patogenese
Hvis man er homozygot i et HPA-system, kan kroppen danne antistoffer rettet mot det manglende antigenet. Forutsetningen er at immunsystemet eksponeres for blodplater som uttrykker det manglende antigenet. Det kan enten skje via uforlikelige blodtransfusjoner eller graviditeter. En gravid kvinne kan immuniseres hvis fosteret uttrykker et fremmed HPA, arvet fra far, på sine blodplater (se figur 1). Immuniseringen kan skje i løpet av graviditeten eller under fødselen, sannsynligvis som resultat av en føtomaternell blødning (6).
Anti-HPA-antistoffer av IgG-klasse kan passere placenta, enten i det aktuelle svangerskapet (ved immunisering i forbindelse med graviditet) eller i neste svangerskap (ved immunisering under fødselen).
Dersom det foreligger HPA-uforlikelighet mellom mor og foster, vil maternelle antistoffer i fosterets sirkulasjon binde seg til blodplatene. De blir så brutt ned av fagocytterende celler. Barnet vil som en følge av dette bli trombocytopenisk og utsatt for økt blødningsrisiko (1).
Forekomst
FNAIT forekommer i cirka 1 av 2000 graviditeter, og rammer statistisk sett 20 - 30 foster/nyfødte i Norge hvert år. Tilstanden skyldes som oftest uforlikelighet mellom mor og foster for humant plateantigen-1a (HPA-1a), når mor er HPA-1bb og fosteret har arvet et a-allel fra sin far og dermed er HPA-1ab (1). HPA-1a-alloimmunisering er sterkt assosiert med et spesielt HLA-allel; HLA DRB3*0101. 90 prosent av kvinnene som produserer anti-HPA-1a antistoff er HLA DRB3*0101 positive, mens frekvensen i resten av befolkningen er mindre enn 30 prosent (2).
Anti-HPA-1a antistoff forårsaker 75 – 80 prosent av FNAIT-tilfellene i den kaukasiske befolkningen. Deretter følger anti-HPA-5b som står for cirka 15 prosent av tilfellene, mens cirka fem prosent skyldes anti-HPA-15b. Andre HPA-antistoffer fører sjelden til FNAIT (7,8).
Antistoffer mot HLA klasse I finnes hos cirka 30 prosent av kvinner som har vært gravide, men selv om blodplatene uttrykker HLA klasse I antigener, er det foreløpig ikke vist noen sikker sammenheng mellom slike antistoffer og FNAIT (9).
Symptomer og behandling
FNAIT oppdages gjerne ved at den nyfødte har synlige petekkier, men selv alvorlig grad av trombocytopeni hos barnet kan være asymptomatisk. Den mest fryktede komplikasjonen assosiert med FNAIT er intrakraniell blødning (ICH) som kan føre til blindhet, alvorlige nevrologiske skader og i verste fall død (2). ICH påvises hos opptil 26 prosent av de nyfødte med FNAIT der årsaken er anti-HPA-1a. Dødeligheten i denne gruppen er cirka sju prosent (10).
FNAIT behandles ved at barnet transfunderes med forlikelige blodplater og i noen tilfeller intravenøst immunglobulin. Ultralydundersøkelse av hjernen utføres for å avdekke eventuell ICH. I påfølgende svangerskap bør moren følges opp med jevnlige ultralydundersøkelser og antistoffmålinger. Høyt nivå av maternelt anti-HPA-1a antistoff i siste trimester gir økt risiko for å føde barn med alvorlig FNAIT. Dersom antistoffnivået er > 3 IU/ml, anbefales keisersnitt to - fire uker før termin med forlikelige blodplater i beredskap til barnet (transfunderes ved platetall < 35 x 109/l) (2,6).
Laboratorieanalyser
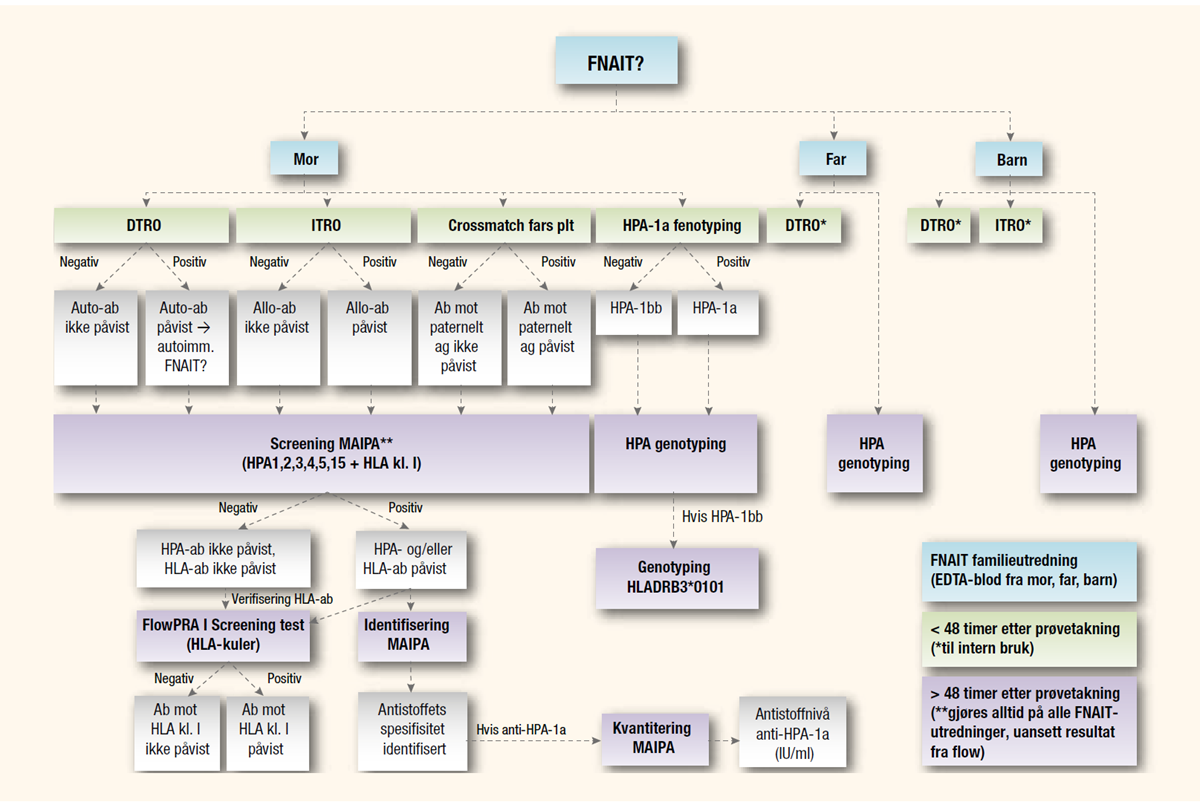
Diagnostisering av FNAIT involverer en rekke ulike laboratorieanalyser, og prosessen er både tids- og arbeidskrevende (se figur 2). Det kan ta to - fire uker før et endelig svar foreligger. Flowcytometriske screeningundersøkelser gjøres imidlertid innen 48 timer etter prøvetakning, og tillater rask påvisning av platereaktive antistoffer i morens plasma.
Indirekte trombocyttantistofftest (ITRO)
Platereaktive alloantistoffer påvises ved hjelp av indirekte trombocyttantistofftest (ITRO), hvor mors plasma inkuberes med intakte blodplater fra åtte forskjellige blodgivere (blodplatepanel). Hvis det finnes platereaktive antistoffer i mors plasma, vil de binde seg til de korresponderende antigenene på blodplatene i panelet. Binding av maternelle alloantistoffer detekteres så ved hjelp av et sekundært fluorescensmerket anti-humant IgG og flowcytometri (11).
Ved å benytte det samme testprinsippet (ITRO), gjøres en crossmatch mellom mors plasma og fars blodplater for å påvise maternelle antistoffer mot paternelle lavfrekvente antigener.
Direkte trombocyttantistofftest (DTRO)
Platereaktive autoantistoffer påvises ved hjelp av direkte trombocyttantistofftest (DTRO). Prinsippet er som for ITRO, med den forskjellen at vi nå inkuberer mors plasma med hennes egne blodplater. Dette gjøres for å ekskludere diagnosen føtal/neonatal autoimmun trombocytopeni, en tilstand hvor mor har autoantistoffer mot egne blodplater som – hvis de er av IgG-klasse – kan krysse placenta og gi trombocytopeni hos barnet. Dette er en mindre alvorlig tilstand enn FNAIT, men viktig å utelukke (12).
HPA-1a fenotyping
HPA-1a fenotyping muliggjør rask identifisering av HPA-1bb personer. Fullblod fra mor inkuberes med et fluorescensmerket monoklonalt antistoff som binder seg spesifikt til HPA-1a positive blodplater. Binding av antistoffet detekteres ved hjelp av flowcytometri (13). Dersom mors blodplater er negative i flow, har hun ikke HPA-1a-allelet og er dermed HPA-1bb. Resultatet fra fenotyping må imidlertid alltid verifiseres gjennom genotyping som gjøres senere i utredningsprosessen.
Monoclonal antibody-specific immobilization of platelet antigens (MAIPA)
De flowcytometriske screeningundersøkelsene er relativt sensitive, men kan ikke skille mellom anti-HPA og anti-HLA-antistoffer. Det vil si, de har lav spesifisitet dersom en prøve inneholder begge typer antistoffer. Så for å bekrefte og sikkert identifisere antistoffer påvist med flowcytometri, benyttes et glykoproteinspesifikt assay. Monoclonal antibody-specific immobilization of platelet antigens (MAIPA) er en teknikk som gjør det mulig å identifisere et antistoffs spesifisitet, selv om plasma inneholder en blanding av ulike antistoffer.
Mors plasma inkuberes med blodplater fra blodgivere med kjent HPA-genotype eller fars blodplater. Maternelle antistoffer vil binde seg til det korresponderende antigenet/glykoproteinet på blodplatene. Deretter isoleres de ulike glykoproteinene ved hjelp av monoklonale glykoproteinspesifikke antistoffer. Analysen bygger videre på ELISA-prinsippet (Enzyme linked immunosorbent assay), og OD-verdien (optisk tetthet) målt i sluttproduktet er proporsjonal med mengde humant antistoff i prøven (14).
Kvantitering av anti-HPA-1a antistoff
MAIPA-teknikken kan også benyttes til kvantitering av anti-HPA-1a antistoff. Et referanseplasma seriefortynnes (1:2 - 1:64) og inkluderes i MAIPA-oppsettet. En standardkurve plottes på bakgrunn av OD-verdiene. Prøver med høyt antistoffnivå fortynnes slik at de har en OD-verdi som faller innenfor det lineære området av standardkurven, og man benytter deretter kurven for å finne mengden av antistoff i prøvene (15).
FlowPRA I Screening test®
Antistoffer mot HLA klasse I kan også påvises ved hjelp av såkalte FlowPRA-kuler. Denne testen er mer sensitiv enn MAIPA, og brukes for flowcytometrisk screening av antistoffer mot HLA klasse I når MAIPA ikke gir et konklusivt svar.
FlowPRA I Screening test® (One Lambda) inneholder et panel av FlowPRA-kuler, det vil si mikropartikler som er coatet med rensede HLA-antigener. Alle vanlige og mange sjeldne HLA-antigener er representert i panelet. Mors plasma inkuberes med FlowPRA-kulene og hvis det finnes antistoffer mot HLA klasse I i prøven, vil de binde seg til de korresponderende antigenene. Et sekundært fluorescensmerket anti-humant IgG brukes for å detektere binding av humane antistoffer til kulene ved hjelp av flowcytometri (16).
HPA-genotyping
Dersom platereaktive antistoffer påvises hos mor, må det undersøkes om det foreligger tilsvarende HPA-antigenuforlikelighet mellom mor, far og barn. Det er dessuten av diagnostisk verdi å verifisere at mor mangler det HPA-allelet som hun har dannet antistoffer mot.
HPA-genotyping gjøres ved hjelp av TaqMan® allelediskriminering (5’ nuclease assay), der fluorescensmerkede allelespesifikke prober tillater diskriminering mellom allelene a og b i hvert av HPA-systemene. Probesekvensene varierer kun i den ene basen som definerer den enkelte SNP (17).
KASUISTIKK
Når alle laboratorieanalysene er utført, vurderes prøvesvarene av bioingeniørene på referanselaboratoriet i samarbeid med laboratoriets lege. Følgende kasuistikk illustrerer utredningsprosessen nærmere:
På et sykehus på Vestlandet fødes en pike en uke før termin. Dette er morens andre barn, og svangerskapet har forløpt uten komplikasjoner. Pikens fødselsvekt er normal og hun virker ellers frisk, men moren oppdager at barnet lett får blåmerker. Det rekvireres telling av blodplater, og undersøkelsen avslører alvorlig trombocytopeni (platetall 16 x 109/l). Piken transfunderes med tilfeldige blodplater, platetallet stiger deretter til 39 x 109/l for så å falle igjen. Behandlende lege mistenker FNAIT, og blodprøver av mor, far og barn sendes til Nasjonalt referanselaboratorium for avansert blodplateimmunologi på UNN for utredning.
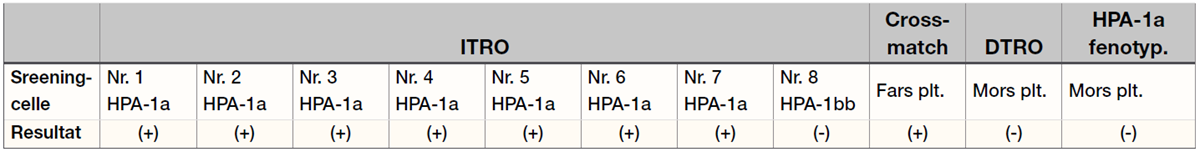
Når familiens blodprøver ankommer referanselaboratoriet, prepareres prøvematerialet umiddelbart slik at de innledende flowcytometriske undersøkelsene kan utføres allerede samme dag (se tabell 2).
Indirekte trombocyttantistofftest (ITRO) avslører reaktivitet i mors plasma mot screeningcellene 1 – 7 i blodplatepanelet som er kjente HPA-1a blodgivere. Det påvises ikke reaktivitet mot screeningcelle 8 som er en kjent HPA-1bb blodgiver. Dette reaktivitetsmønsteret er typisk for prøver som inneholder anti-HPA-1a antistoff, så bioingeniøren mistenker umiddelbart at dette dreier seg om en FNAIT grunnet maternelle anti-HPA-1a antistoffer. Antigenspesifisiteten kan imidlertid ikke sikkert slås fast før det er gjort MAIPA.
Crossmatch mot fars blodplater viser at mor har IgG-antistoffer i plasma som reagerer med paternelle blodplateantigener.
Direkte trombocyttantistofftest (DTRO) viser ingen autoreaktivitet i mors plasma mot hennes egne blodplater, og føtal/neonatal autoimmun trombocytopeni kan utelukkes.
HPA-1a fenotyping av morens blodplater viser at mor med stor sannsynlighet er HPA-1bb (HPA-1a negativ). Dette støtter mistanken om mulige anti-HPA-1a antistoffer.
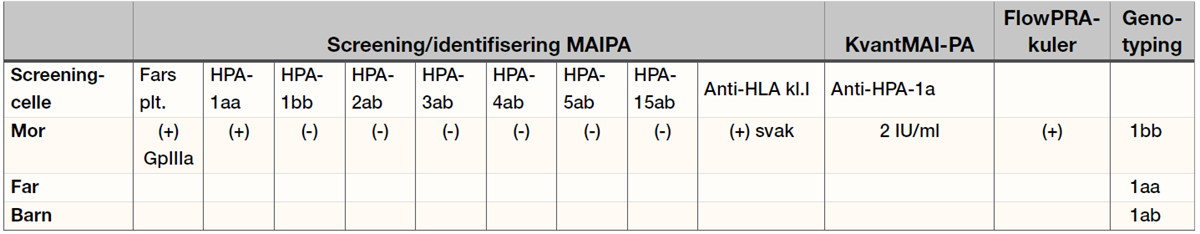
Rekvirenten informeres umiddelbart om at barnets trombocytopeni sannsynligvis skyldes FNAIT forårsaket av anti-HPA-1a antistoffer overført fra mor til barn. Ved behov for flere blodplatetransfusjoner, bør barnet få konsentrat fra en forlikelig HPA-1bb blodgiver. På laboratoriet fortsetter arbeidet for å identifisere det påviste platereaktive antistoffet (se tabell 3).
MAIPA utført med farens blodplater viser at mors plasma inneholder platereaktive antistoffer rettet mot antigener på GpIIIa. Etter videre utredning mot HPA-1aa og HPA-1bb screeningceller, identifiseres disse antistoffene som anti-HPA-1a. Det påvises ikke antistoffer mot HPA-1b, -2, -3, -4, -5 og -15. Mulige anti-HLA klasse I antistoffer påvises, men reaksjonen i MAIPA er noe svak og dette funnet undersøkes videre med supplerende teknikker.
Kvantitering av anti-HPA-1a antistoff viser et maternelt antistoffnivå på 2 IU/ml. Dette regnes ikke som spesielt høyt (jmf. sectiogrense > 3 IU/ml), men det er ikke uvanlig at antistoffnivået er høyest tidlig i graviditeten for så å synke nærmere termin (6).
FlowPRA I Screening test® viser at mor har anti-HLA klasse I antistoffer i sitt plasma.
TaqMan® allelediskriminering verifiserer at mor er HPA-1bb. Far er HPA-1aa mens barnet er HPA-1ab som følge av å ha arvet et b-allel fra sin mor og et a-allel fra sin far.
Diagnose
Referanselaboratoriets konklusjon etter en samlet vurdering av alle prøvesvarene er følgende:
- Det påvises platereaktive antistoffer i mors plasma, spesifisitet: anti-HPA-1a. Antistoffnivå: 2 IU/ml.
- Mors genotype: HPA-1bb. Hun mangler HPA-1a-allelet, dette støtter at hun kan danne anti-HPA-1a antistoff som følge av alloimmunosering.
- Barnets genotype: HPA-1ab. Det påvises uforlikelighet mellom mor og barn i alloantigensystemet HPA-1.
- Det påvises ytterligere platereaktive antistoffer i mors plasma, spesifisitet: anti-HLA klasse I. Slike antistoffer er imidlertid ikke vist å forårsake FNAIT (9).
Svaret som sendes til rekvirenten konstaterer at piken har føtal/neonatal alloimmun trombocytopeni forårsaket av anti-HPA-1a antistoff. Det anbefales at mor følges opp i fremtidige svangerskap med kliniske undersøkelser/ultralyd og kvantitering av anti-HPA-1a antistoff.
Når rekvirenten mottar dette svaret, er familien reist hjem fra sykehuset. Barnets blodplatetall er normalt, og det foreligger heldigvis ikke rapporter om ICH/hjerneskade. Resultatet fra utredningen er likevel viktig, både for å forklare barnets trombocytopeni men også med tanke på parets fremtidige barn. I neste svangerskap kan mor nå inkluderes i det anbefalte oppfølgingsprogrammet, noe som gir økt trygghet for mor og mindre risiko for blødningsskader hos barnet (2).
Konklusjon
Et klassisk FNAIT-kasus er her brukt for å vise hvordan tilstanden utredes på Nasjonalt referanselaboratorium for avansert blodplateimmunologi. I dette tilfellet visste ikke den gravide kvinnen at hun var i risikogruppen for dannelsen av maternelle platereaktive antistoffer, og ingen forholdsregler ble tatt – verken i løpet av graviditeten eller under forløsningen. Heldigvis gitt det bra med dette barnet, men dessverre er ikke alle FNAIT-barn like heldige.
Både i Norge og i resten av verden forskes det aktivt på FNAIT, blant annet er en mulig profylaktisk behandling for å hindre immunisering under utvikling (se www.profnait.eu). Kanskje vil en fungerende profylakse overbevise norske myndigheter om at det er riktig å innføre screening med tanke på platereaktive antistoffer i svangerskapsomsorgen.
Inntil slik screening iverksettes, er det imidlertid viktig at alle barn som fødes med symptomer på trombocytopeni undersøkes for FNAIT. Så kan i alle fall fremtidige søsken nyte godt av det tilbudet om oppfølging som eksisterer per i dag.