Hovedbudskap
- Rutiner rundt blodprøvetaking ved parenteral ernæring (PE) har ikke blitt endret til tross for mindre intensiv behandling som skulle tilsi mindre risiko for interferens i prøvesvar.
- I denne begrensede studien ga PE lite utslag på lipemi-indeks og triglyserider og medførte lite påvirkning på vanlige biokjemiske og hematologiske parametre.
- Blodprøvetaking under lavdosert PE kan sannsynligvis utføres uten betydningsfull interferens i rutineprøver, men bør undersøkes i flere studier.
Av RITA LOFTHUS MICHALSEN, ELIZABETH BASSILA KING og RAGNHILD NOME
Introduksjon
Mange innlagte pasienter får kaloritilskudd i form av parenteral ernæring (PE), og blodprøvetaking av pasienter som får denne behandlingen er dagligdags ved norske sykehus. Imidlertid er interferens i prøvesvar forårsaket av PE en bekymring, og rutinene knyttet til blodprøvetakingen ved denne behandlingen er omdiskuterte. På Avdeling for medisinsk biokjemi på Diakonhjemmet sykehus hadde vi tidligere en prosedyre på at infusjon med PE måtte være avstengt i åtte timer før blodprøvetaking, mens andre har praktisert fire timer (1). En slik prosedyre er i liten grad forenlig med øvrige rutiner i klinikken og blir ofte ikke overholdt i praksis.
Parenteral ernæring
Dagens PE gis som en ”alt i ett”- sammensetning med fettemulsjon av både middelslange og lange fettsyrer, i tillegg til aminosyrer og glukose. Infusjonen av PE skjer via sentral eller perifer vene og pågår som regel store deler av døgnet. Triglyseridverdien er spesielt viktig å overvåke ved PE for å unngå overdose som kan medføre komplikasjoner (2), og verdien bør derfor ikke overstige 3 mmol/L under infusjon. Anbefalingen om åtte timer avstengt PE stammer fra en eldre ernæringsmetode (Intralipid, Fresenius Kabi) enn den som er hyppigst brukt i dag. Intralipid inneholder langkjedede fettsyrer i store syntetiske lipidmolekyler som skulle likne kylomikroner (3), og pågikk ofte over omtrent en fjerdedel av døgnet. Det var dermed et mer intensivt regime enn dagens praksis.
Lipemi
Ved høyt lipidnivå blir serumet blakket (egenfarge) og får en melkeaktig konsistens. Dette fenomenet kalles turbiditet og skyldes at lipidpartikler reduserer lysgjennomstrømming i væsken. Laboratoriet måler serum hemolyse-, ikterus-, og lipemi-indeks (HIL-indeks) på alle serumprøver for å vurdere fare for interferens. Lipemi-indeks (L-indeks) baserer seg på turbiditet i prøveglasset i form av lysabsorpsjon rundt 700 nm og er ofte standardisert mot det syntetisk framstilte Intralipid (4, 5). Dette kan være en svakhet for overføringsverdien av L-indeks til klinikken (6). Triglyseridnivå er vist å ha dårlig samsvar med turbiditet og brukes derfor ikke til denne vurderingen (7). Store lipidmolekyler, som kylomikroner, bidrar til økt turbiditet og dermed utslag på L-indeks. Mindre lipidmolekyler har derimot mindre påvirkning (8). Dagens PE består i større grad av middelslange fettsyrer og slår dermed ikke nødvendigvis ut på L-indeks i samme grad som ved høyt lipidnivå av andre årsaker (7). Parallelt til dette, er også komplikasjoner som følge av overdosering med dagens PE kun sporadisk rapportert (9). Ettersom lipidinterferens også oppstår via andre mekanismer enn økt turbiditet, kan PE dermed teoretisk gi interferens som ikke varsles ved L-indeks.
Lipidinterferens
Lipemi er hovedsakelig knyttet til fire typer interferens (8):
- spektrofotometrisk
- konsentrasjonsforstyrrelse
- nonhomogenitet
- fysiokjemisk
Den spektrofotometriske interferensen er vanligst og kan være problematisk for turbidimetriske og nefelometriske analyser ved at fettpartiklene forstyrrer lysabsorpsjon eller lysspredning. Enzymatiske metoder som baserer seg på reduksjon/oksidasjon av NAD(P) og lysabsorbsjon ved 340 nm, er særlig sårbare (8). Overskredet L-indeks skal varsles på disse analysene.
Konsentrasjonsforstyrrelse kan man få som følge av at vannfasen blir mindre, og dette gir særlig utslag på elektrolytter målt med indirekte ioneselektiv elektrode (ISE) (for eksempel pseudohyponatremi), men ikke ved direkte ISE (blodgassinstrument) (6). Interferens knyttet til nonhomogenitet i prøven skjer etter sentrifugering, hvor lipider vil legge seg i et lag øverst i prøverøret. Graden av interferens avhenger av i hvilket nivå i røret prøvematerialet pipetteres fra, og i hvilken fase i røret analytten legger seg. Fettløselige hormoner vil kunne legge seg i fettfasen.
Fysiokjemisk interferens ses eksempelvis der lipemien forstyrrer antigen/antistoff-binding i immunoassays og har vært rapportert tidligere (10). Lipemi er også assosiert med hemolyse (11) som gir særlig spektrofotometrisk interferens.
Dessverre finnes det få studier som har undersøkt hvordan PE påvirker prøvesvar på pasienter. De få studiene som finnes er lite overførbare til klinikken fordi de stort sett har vært utført in vitro med store syntetiske lipidmolekyler (Intralipid), eller gjort på friske personer med høyere dosering enn det som vanligvis benyttes ved PE (12-15).
Vi ønsket oss en mer praktisk gjennomførbar prosedyre for blodprøvetaking ved PE, og vårt formål var derfor å avklare eventuell interferens av lipider i prøveresultater hos pasienter under behandling med PE som brukes i dag. Vi ville undersøke et utvalg vanlige analytter og i hvilken grad prøvetakingstidspunktet har betydning. Studien ble utført ved Avdeling for medisinsk biokjemi ved Diakonhjemmet sykehus i Oslo i 2013-14.
Materiale og metode
Personvernombudet for forskning og kvalitetssikring ved Oslo universitetssykehus godkjente dette som et kvalitetsprosjekt. De aktuelle pasientene ga selv skriftlig informert samtykke. Hvert prøveglass ble avidentifisert før analysering.
Utvalg
Pasienter ved ordinær sengepost med planlagt oppstart PE, ble rekruttert i samarbeid med kliniske ernæringsfysiologer ved Diakonhjemmet sykehus i Oslo. Utvalget var basert på pasienter som fikk infusjon i den ene armen. Vurdering av pasientens vener ble gjort ved inklusjon. Dersom venene ble ansett for å ikke å være godt egnet for blodprøvetaking, ble pasienten ekskludert.
Prøvehåndtering og analysering
Blodprøver ble tatt henholdsvis før oppstart av PE (0-prøve), under pågående PE-infusjon og 15 minutter og fire timer etter avstengt infusjon. Pasienten ble venepunktert i motsatt arm i forhold til infusjonen. Det ble tatt tre blodprøveglass ved hvert tidspunkt, ett EDTA-glass til hematologi (K2E EDTA; Becton, Dickinson and Company, Plymouth, UK) og to serumgelglass (et til direkte ISE og et til biokjemi) (Serum Separation tube II Advance; Becton, Dickinson and Company, Plymouth UK). Følgende parametere ble analysert for hvert tidspunkt: hemoglobin, trombocytter, lipidstatus, elektrolyttstatus, kalsium (både total og fritt), magnesium, fosfat, glukose og bilirubin. HIL-indekser i serum ble målt for å avklare eventuelle brudd på analyttspesifikke grenser.
De hematologiske parameterne ble analysert fortløpende etter prøvetaking på Sysmex XE 5000 (Siemens Healthineers, Erlangen, Tyskland). Serumprøvene koagulerte i minimum 30 minutter før sentrifugering ved 2000g i 11 min og deretter satt på kjølerom. Serumprøvene ble analysert samlet påfølgende dag på Cobas 6000 (Roche Diagnostics, Mannheim, Tyskland) og ABL835 (Radiometer Medical ApS, Brønshøj, Danmark).
Statistikk
Prøvesvarene for pasientene ble samlet i et regneark (Microsoft Excel). Prosentavviket fra 0-prøven ble beregnet og sammenlignet mot forventet variasjon basert på total variasjonskoeffisient (VKTotal). VKTotal ble beregnet ved hjelp av følgende formel:
VKTotal =√(〖VKa〗^2+VKi²) , der VKa (analytisk) er hentet fra Avdeling for medisinsk biokjemi ved Diakonhjemmet sykehus og VKi (innen person) er hentet fra databasen til European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) (16).
Der den prosentvise endringen fra 0-prøven med 95% sannsynlighet representerte en ikke-tilfeldig endring, ble litt forenklet tolket som >2,8* VKTotal (17).
For å undersøke for lipidmediert volumfortrengning i blodplasma ved indirekte ISE, ble i tillegg prøvesvar på elektrolytter tatt ved samme tidspunkt sammenlignet mellom indirekte og direkte ISE.
Resultater
Seks pasienter med median alder 74 år (61-81 år), hvorav to var kvinner, ble inkludert. Alle seks fikk PE som støtteernæring, i form av 800 kcal-1000 kcal SmofKabiven perifer (Fresenius Kabi, Halden). Dette tilsvarer omtrent halvparten av et basalt kaloribehov over et 20-timers intervall (60mL/time). Opplysninger om øvrig kaloriinntak og eventuelt andre infusjoner ble ikke samlet inn. Blodprøver ble tatt før, under og etter infusjon for alle pasientene, bortsett fra én der infusjonen var avsluttet før prøvetakning. De fleste av prøvesvarene var innenfor referanseområdet eller kun lett avvikende. Ingen av pasientene hadde alvorlig patologiske prøvesvar.
Ved alle tidspunkter og for alle pasientene, var triglyserider innen referanseområdet (0,45-2,60 mmol/L) (figur 1A). Serum L-indeks var i området 5-18 mg/dL (figur 1B) og Hemolyse-indeks var ≤10 mg/dL ved alle tidspunkt (figur 1C).
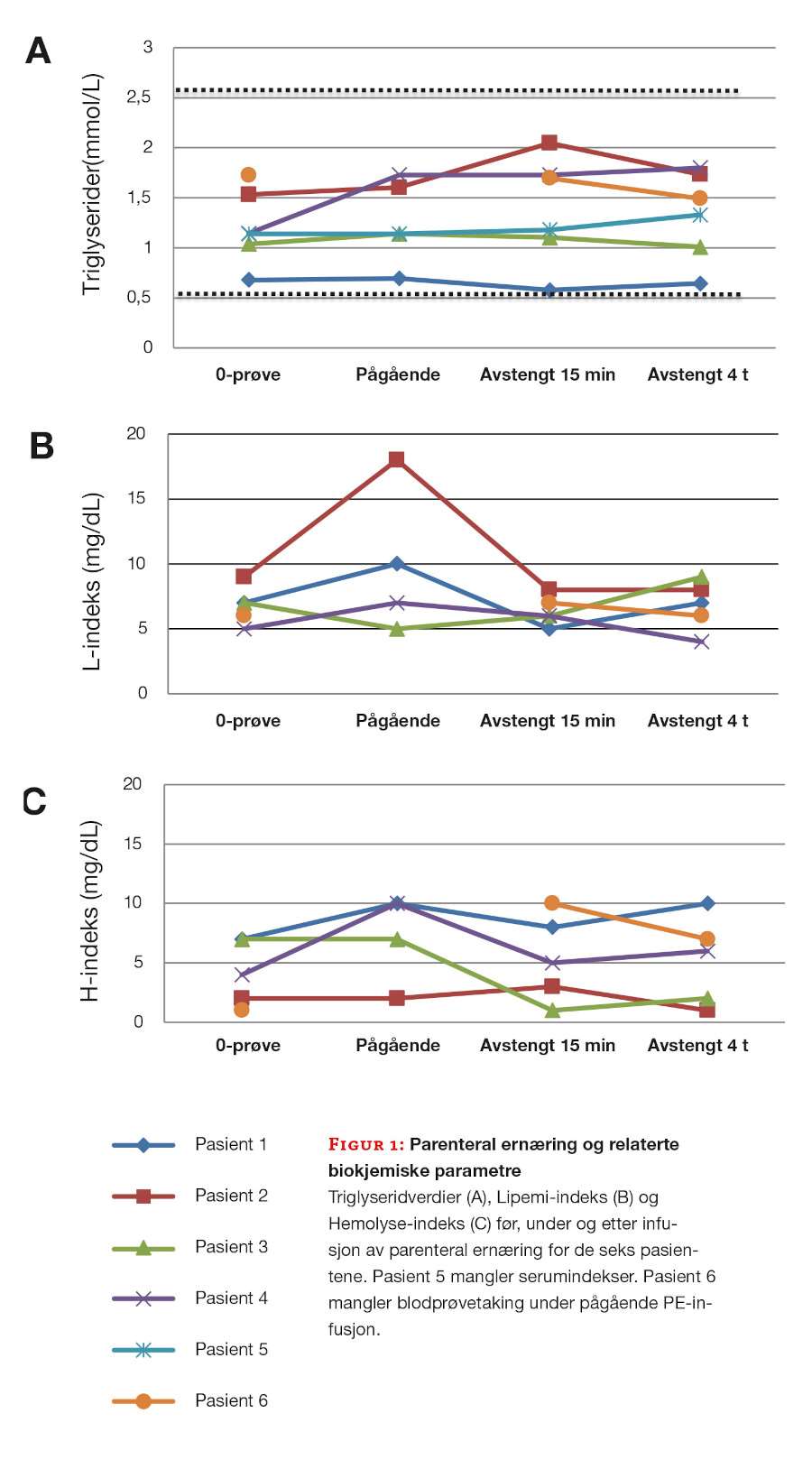
Serumindekser manglet på en av pasientene. De analyttspesifikke grensene for HIL-indeks ble ikke overskredet ved noen av tidspunktene. Ved prøver fra samme tidspunkt under pågående infusjon, var det maksimal forskjell på 1,5% mellom natrium målt ved indirekte og direkte ISE. Hos de fleste pasientene var det små forandringer i blodprøvesvarene i løpet av observasjonstiden (tabell 1).
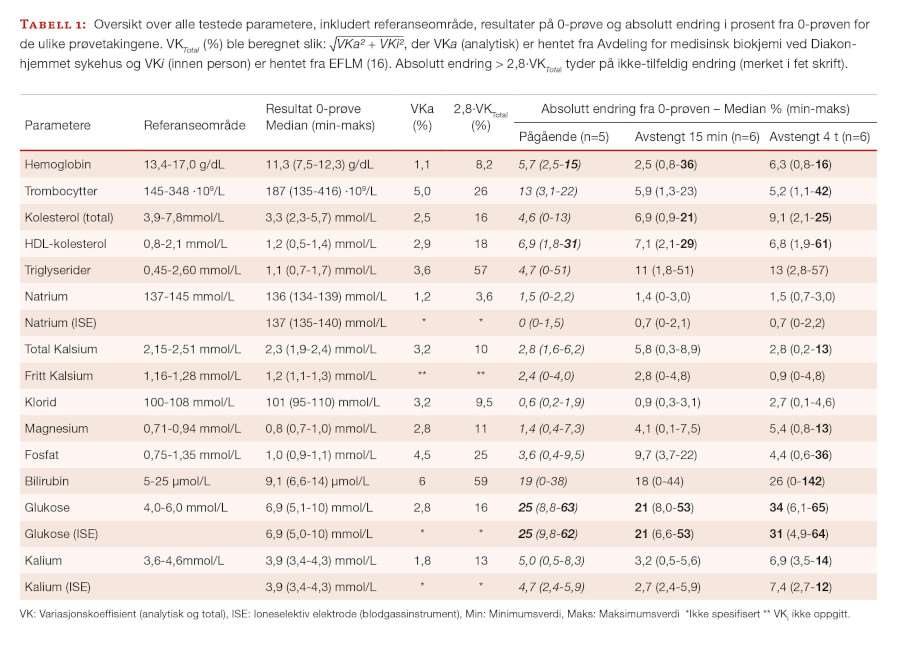
En endring på >2,8*VKTotal er per definisjon større enn det man vanligvis forventer med biologisk og analytisk variasjon og tyder på en ikke-tilfeldig endring hos pasienten. Bortsett fra glukose, ga ikke den mediane prosentvise endringen fra 0-prøven holdepunkt for ikke-tilfeldig endring (tabell 1). Under pågående infusjon ble det kun registrert observasjoner >2,8*VKTotal for hemoglobin og HDL-kolesterol og disse holdt seg uendret til fire timer etter infusjonen.
Diskusjon
I denne studien på seks innlagte pasienter behandlet med PE som støtteernæring, fant vi få holdepunkter for lipidinterferens i de undersøkte hematologiske og biokjemiske parametrene. For de analyttene hvor det var holdepunkt for ikke-tilfeldige endringer fra 0-prøven og til prøven tatt under pågående infusjon, holdt endringen seg stabil ved de påfølgende observasjonene. Ettersom endringene holdt seg stabile fra pågående til avsluttet infusjon, tror vi forklaringen for parameteren Hb er endret hydreringsgrad i pasienten, og at endringene for øvrige metabolske analytter (glukose, triglyserider, kolesterol osv) skyldes kaloritilførsel. Vi tolker derfor ikke dette som relatert til interferens fra PE, men heller uttrykk for reelle endringer som følge av PE og annet kalori- og væskeinntak hos pasienten.
Ettersom PE var lavdosert og medførte liten endring i både L-indeks og triglyseridnivå, taler det totalt sett for liten fare for lipidinterferens.
Måling av HIL-indeksene muliggjør automatisk varsling av fare for interferens dersom analyttspesifikke rutiner er etablert og kunnskap om feilkilden foreligger. Selv om det finnes en retningslinje rundt håndtering av slike varsler (CLSI Guideline C56-A), gjenstår det ifølge internasjonal litteratur fortsatt mye arbeid på dette feltet (6, 8).
Analyttene ALAT, ASAT og gentamicin har lavest toleransegrense for lipemi i våre prosedyrer (L-indeks <150 mg/dL). Den høyeste L-indeksen målt ved denne begrensede studien var 18 mg/dL og således langt under nedre grense selv for de mest påvirkelige analyttene. De to øvrige serumindeksene var også langt under nedre grense for varsel. Ettersom det i dag er standardrutine å måle HIL-indekser på alle serumprøveglass, vil fare for spektrofotometrisk interferens på vanlige biokjemiske analytter kunne fanges opp dersom toleransegrensene er adekvat definert.
Variasjonene i prøvesvar som ble sett, kan stort sett tilskrives analytisk og biologisk variasjon og eventuelt infusjon og inntak av elektrolytter og kalorier. Ettersom studien ville belyse eventuell interferens under pågående PE, var det endringer ved dette tidspunktet som hadde størst interesse i så måte. Mange av endringene som ble observert under pågående infusjon var imidlertid sannsynligvis uttrykk for reelle endringer og ikke knyttet til lipidinterferens ettersom de ble gjenfunnet i prøven som ble tatt på morgenen etter fire timer med avstengt infusjon. Den prosentvise endringen er ikke alltid egnet til å vise variasjonen for lave verdier, eksempelvis hadde en av pasientene en bilirubinstigning fra 6,6 ved 0-prøven til 16µmol/L fire timer etter avstengt infusjon, noe som utgjorde en endring på 142%, selv om begge verdier var innenfor referanseområdet og således «normale».
Analyser som ikke baserer seg på fotometri, kan være utsatt for andre typer interferens fra lipider. I vår studie var det godt samsvar mellom elektrolytter målt med indirekte og direkte ISE, og dermed ikke holdepunkter for lipidutløst konsentrasjonsforstyrrelse i prøvene fra de undersøkte pasientene. Ettersom også behandlingen styres utfra prinsippet om at triglyseridene skal være lave, vil det også tilsi at faren for lipidinterferens bør være lav ved denne behandlingsformen.
En svakhet i studien er at det er få inkluderte pasienter og at de inkluderte kun fikk PE som støtteernæring. Hvorvidt resultatene er overførbare til pasienter som får total parenteral ernæring eller høyere infusjonstakt, er usikkert og bør undersøkes. En annen svakhet er at mange viktige analytter og analysemetoder som teoretisk kan være utsatt for lipidinterferens ikke ble inkludert. I tillegg kan det diskuteres hvorvidt >2,8*VKTotal er egnet til å påvise ikke-tilfeldige forskjeller. For noen av analyttene, er kombinasjonen av analytisk og biologisk variasjon veldig stor (over 50%), og det er en klar risiko for at ikke-tilfeldige forskjeller kan bli oversett dersom man ukritisk bruker dette som endringsparameter. En styrke i studien er at den er utført klinikknært, og at den setter fokus på en prosedyre som kanskje ikke har blitt oppdatert i tråd med endret behandling.
Konklusjon
Vi fant ikke holdepunkt for at PE gitt kun som støtteernæring ga interferens i vanlige hematologiske og biokjemiske analytter ved dette kvalitetsprosjektet. Både L-indeks og triglyserider var tilnærmet upåvirket av behandlingen. Endret sammensetning av PE og lavere infusjonshastighet, har sannsynligvis bidratt til redusert fare for lipidinterferens i blodprøver fra pasienter med PE-behandling.
Funnene i denne begrensede studien fra 2013-14 ble støttet av tilsvarende utprøvinger på andre sykehus (upubliserte data). Ettersom L-indeks måles i alle prøver og analyttspesifikke grenser er etablert, tilsier det at faren for betydelig interferens som følge av lavdosert PE bør være liten. Med denne begrunnelsen, forenklet vi i 2015 rutinene ved vår avdeling rundt blodprøvetaking av pasienter som får PE. I den nye prosedyren vår presiseres det at blodprøver ikke skal tas fra arm med pågående PE. Dersom det allikevel må tas prøve fra arm med pågående infusjon, må den stoppes i minimum 15 minutter før prøvetaking.
Hvordan total parenteral ernæring påvirker blodprøvesvar og om lipidinterferens oppstår ved andre analytter, kan være aktuelt å undersøke videre.
Takk
Forfatterne ønsker å takke Avdeling for medisinsk biokjemi ved Diakonhjemmet Sykehus for å stille til veie nødvendige ressurser for å gjennomføre prosjektet. Vi takker også ernæringsfysiologer ved Avdeling for klinisk aktivitet for samarbeid og råd underveis. En takk også til redaksjonen i Bioingeniøren for oppfordring til å skrive denne artikkelen.
Interessekonflikter: Ingen oppgitt