For å kunne forebygge og behandle sykdom mer effektivt, både hos mennesker og dyr, trenger vi bedre forståelse av ulike faktorers betydning for sykdomsutviklingen. Vi må ha mer kunnskap om den rolle arv og miljø spiller, og ikke minst om samspillet og vekselvirkningen mellom disse. Mange forskere forsøker å finne svar på slike spørsmål ved å studere DNA, RNA og proteiner i prøver av blod, vev og annet materiale både fra pasienter og fra friske individer.
Interessen for RNA har økt betydelig de senere årene. Messenger RNA (mRNA) er den direkte forbindelsen mellom genene som koder for et protein og de proteinene som lages etter denne koden. Innen moderne kreftforskning undersøkes mRNA-mønsteret i kreftcellene, for å kartlegge ekspresjonen av ulike gener og deres funksjon (1), noe man antar kan avsløre nye sider ved sykdommens biologi. Man håper at RNA kan få betydning som biomarkør for ulike typer kreft og at undersøkelser av RNA-profil i biologiske prøver kan bidra til tidligere diagnose og redusert dødelighet (2). Det er også stor interesse for om RNA kan benyttes som utgangspunkt for å utvikle nye typer medikamenter (3).
Samtidig som interessen for RNA øker, blir utfordringene med å håndtere RNA på laboratoriene mer synlige. Straks biologisk materiale separeres fra et levende organ, starter degradering av RNA. Prosessen er avhengig av nukleaser med RNase-aktivitet (4). Potensielle kilder til RNaser i laboratoriet kan være mikroorganismer i luften, på ulike overflater, i løsninger og vannforsyning, til og med på pipettespiser og i reaksjonsrør. Hud og kroppsvæsker, for eksempel spytt, er andre kilder til kontaminering med RNaser. I laboratorier hvor man dyrker bakteriestammer for plasmidpreparering eller kloning, og ved arbeid med andre bakterielle produkter som restriksjonsenzymer, er det stor risiko for kontaminering med RNaser. Ved spesielle metoder der man bruker RNaser, for eksempel ”nuclease protection assays”, er risikoen for kontaminering særlig stor (5).
Nedkortet prøvetakingstid, effektive transportmetoder, optimaliserte ekstraheringsprosedyrer og systematisk kvalitetskontroll, er viktige elementer i biobankvirksomhet i sin alminnelighet, og spesielt i håndteringen av RNA. Siden det ikke finnes noen allment akseptert standardmetode, varierer framgangsmåten mye mellom forskjellige laboratorier. Ettersom mange faktorer kan ha betydning for RNA-integriteten, vil ulikheter i prosedyrer føre til forskjeller i nivå av RNA-ekspresjon i ulike laboratorier, noe som kan påvirke resultatet av genekspresjonsstudier (6). Optimalisering og standardisering av metodene blir derfor spesielt viktig for å kunne stole på resultater av genuttrykksprofilering, og for å kunne sammenholde resultater fra ulike sentra.
Målet med denne studien var å undersøke hvordan innsamlings- og lagringsmetoden påvirker RNA-kvaliteten i vevsmateriale, samt å undersøke betydningen av RNA-kvaliteten for analyser som sanntids-PCR. Slik kunnskap vil være nyttig for forskning på RNA, og gi et grunnlag for optimalisering av prosedyrer for innsamling av prøvemateriale som senere kan benyttes til RNA-analyser. I studien undersøkte vi oppbevaring ved tre forskjellige temperaturer, samt oppbevaring i et preserveringsmiddel som skal bevare RNA.
Materiale og metode
Leverprøver fra rotter
Det ble samlet leverprøver fra 11 friske unge hannrotter av stamme Wistar. Lov om dyrevelferd og etiske retningslinjer ble fulgt.
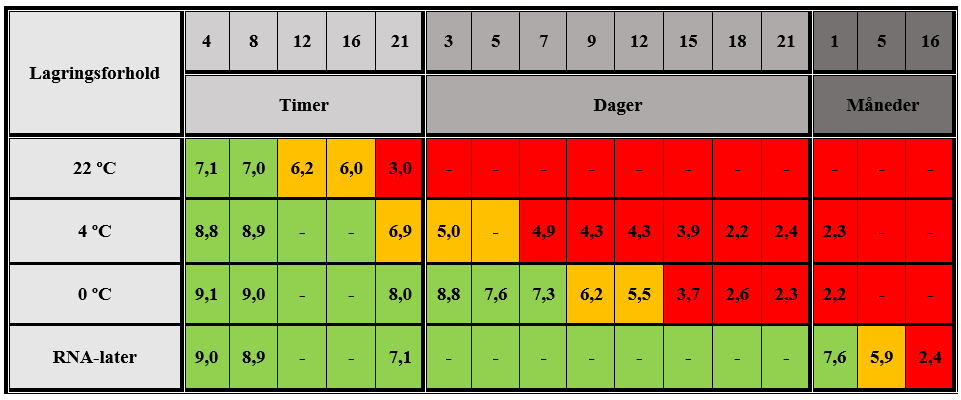
Forsøksdyrene ble anestesert ved subkutan injeksjon av 4 ml ”haldol-miks” (2 ml haldol, 3 ml fentanyl, 3 ml midazolam og 4 ml sterilt vann), og deretter barbert på buken for å unngå forurensning av hår og andre substanser. Etter at bukveggen var åpnet, ble leveren tatt ut og delt i skiver med størrelse cirka 1 x 3 x 20 mm ved hjelp av en spesialdesignet kniv. Materialet ble overført til sterile plastrør for lagring av vev ved tre forskjellige temperaturbetingelser; 22 ºC (tørr i romtemperatur), 4 ºC (0, 9 % NaCl i kjøleskap), 0 ºC (tørr på isvann) og ved 4 ºC i preserveringsmiddelet RNA-later (Qiagen, Tyskland) (figur 1, under).
I tillegg ble noen vevsskiver plassert på en plastfolie og umiddelbart nedfryst mellom to metallplater som var avkjølt til -196 ºC med flytende nitrogen, og deretter flyttet over i mekanisk ultrafryser for videre oppbevaring ved -80 ºC. Disse prøvene ble brukt som referansemateriale (7).
RNA ekstraksjon
RNA ble isolert med High Pure RNA Tissue Kit (Roche, Tyskland) i henhold til brukermanualen. Fragmenter av vevsskiver ble veid og 30 mg ble overført til rør med keramiske kuler tilsatt 700 µl lysering/bindingsbuffer med guanidin tiocyanat. Vevsmaterialet ble så homogenisert i MagNA lyser (Roche, Tyskland) ved 3075 g i 50 sekunder. Løsningen ble deretter oppbevart ved romtemperatur i 30 minutter, før 350 µl av supernatanten ble pipettert over i et sterilt Eppendorfrør. Til slutt ble 50 µl renset RNA-løsning frigjort fra glassfiber-filteret ved å tilsette en buffer med lav saltkonsentrasjon. Fra hver prøve ble det produsert tre ekstrakter. Konsentrasjon og renhet av ekstrahert RNA ble målt i et ND-1000 spektrofotometer (Thermo Scientific, USA) med absorbansavlesning ved 230, 260 og 280 nm.
Måling av RNA-integritet
RNA-integritet ble bestemt med kapillærelektroforese ved hjelp av Agilent 2100 Bioanalyser med Agilent RNA 6000 Kit (Agilent Technologies, USA). I instrumentet blir RNA-fragmenter separert etter størrelse, og et mål på RNA-integritet blir beregnet ved hjelp av programvaren «RNA Integrity Number» (RIN-skår). Det beregnes et tall fra 1-10, hvor 10 representerer intakt RNA og 1 indikerer totalt degradert RNA.
Morfologi
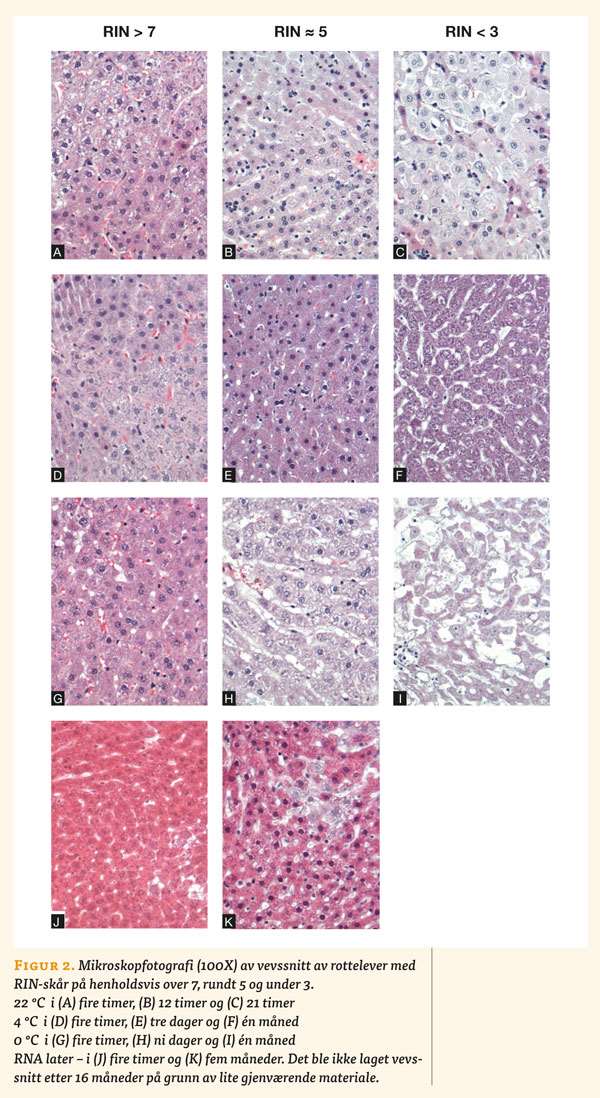
For å vurdere hvordan lagring påvirket vevsmorfologien, ble prøver til lysmikroskopi tatt på ulike tidspunkt fra vevsbiter som var lagret under forskjellige betingelser:
- 22 ºC etter fire, 12 og 21 timer.
- 4 ºC etter fire timer, tre dager og én måned.
- 0 ºC etter fire timer, ni dager og én måned.
- RNA-later etter fire timer og fem måneder.
Prøvene til mikroskopi ble fiksert i 4 % bufret formaldehydoppløsning og innstøpt i parafinvoks. Fra parafinblokkene ble det skåret tynne snitt (ca 4-8 µm) som ble lagt på objektglass og farget med hematoxylin-eosin-safran (HES). Preparatene ble deretter vurdert lysmikroskopisk med «Nikon Eclipse 80i» mikroskop.
cDNA-syntese
Komplementær DNA ble syntetisert ved hjelp av Transcriptor First Strand cDNA synthesis Kit (Roche, Germany) i henhold til brukermanualen. En reaksjonsblanding bestående av total-RNA (1 µg), «Anchored Oligo dT-primer» (2,5 µM) og destillert vann (dH2O) ble varmebehandlet i 10 minutter ved 65 ºC i en varmeblokk.
Deretter ble «Reactions buffer 5 x cons.» (8 mM MgCl2), «Protector RNase Inhibitor» (40 U/µl), «Deoxynucleotide Mix» (1 mM) og «Transcriptor Reverse Transcriptase» (20 U/µl) tilsatt. cDNA-syntesen ble satt i gang ved å sette reaksjonsrøret i en varmeblokk ved 55 ˚C i 30 minutter. Reaksjonen ble stoppet ved å øke temperaturen til 85 ºC i 15 minutter og deretter sette reaksjonsrøret på isblokk.
Sanntids-PCR
For å sammenligne de ulike RNA-ekstraktene ble mengden av tre husholdningsgener (GADPH, β-actin, og HPRT) undersøkt i prøvene med sanntids-PCR. Dette er gener som generelt anses å være nokså konstant uttrykt, upåvirket av eksperimentelle forhold, og de blir ofte brukt ved studier som en intern standard ved kvantitativ-PCR (8). I tillegg til disse tre husholdningsgenene, ble også mengden mRNA fra et leverspesifikt gen (Agxt) målt. PCR ble utført med 2 µl cDNA-løsning, primere (10 pmol/ml) (tabell 1, under) (TIM MOLBIL, Germany) og 18 µl Light Cycler FastStart DNA masterPLUS HybProbe kit mastermix (Roche, Germany) med LightCycler 2,0 (Roche, Germany). Det ble kjørt en initial denaturering; 95 °C i 10 minutter, og videre 40 sykluser med følgende betingelser: 95 °C i 15 sekunder, 59 °C i 20 sekunder og 72 °C i 30 sekunder. PCR ble gjort på alle de tre ekstraktene fra hver prøve, og for hvert ekstrakt ble reaksjonen gjort i tre replikater.
Hvert oppsett inneholdt en negativ kontrollprøve (kun reaksjonsmiks), en referanseprøve (materiale som var nedfryst umiddelbart i flytende nitrogen (-196 ºC) og videre oppbevart ved -80 ºC), og materiale fra tre forskjellige lagringstider.
Resultater
RIN-skår
RIN-skår i RNA-ekstrakt fra vev som var lagret under ulike betingelser er presentert i tabell 2 (under). Resultatene viser at RIN-skår reduseres til under 7 etter 12 timer når vevet lagres ved 22 ºC, etter tre dager ved 4 ºC, etter ni dager ved 0 ºC og etter fem måneder ved oppbevaring i RNA-later. Ekstrahert RNA fra referansemateriale som var lagret ved -80 ºC i 9, 11, 14 og 17 måneder, viste henholdsvis 8,8; 8,2; 9,2; og 8,2 i RIN-skår.
Morfologi
Snitt fra vev oppbevart under forskjellige lagringsforhold ble vurdert med lysmikroskopi (figur 2, under). Figuren viser typisk utseende på snitt fra materiale med RIN-skår over 7, rundt 5 og under 3, ved de forskjellige lagringsbetingelsene. Man ser tydelige forandringer i vevets struktur, parallelt med utviklingen i RIN-skår. Det observeres redusert antall cellekjerner og mer oppløst cytoplasma med økende tid. Den ekstracellulære avstanden mellom cellene (hvit farge), øker etter lengre tids lagring.
Sanntids-PCR
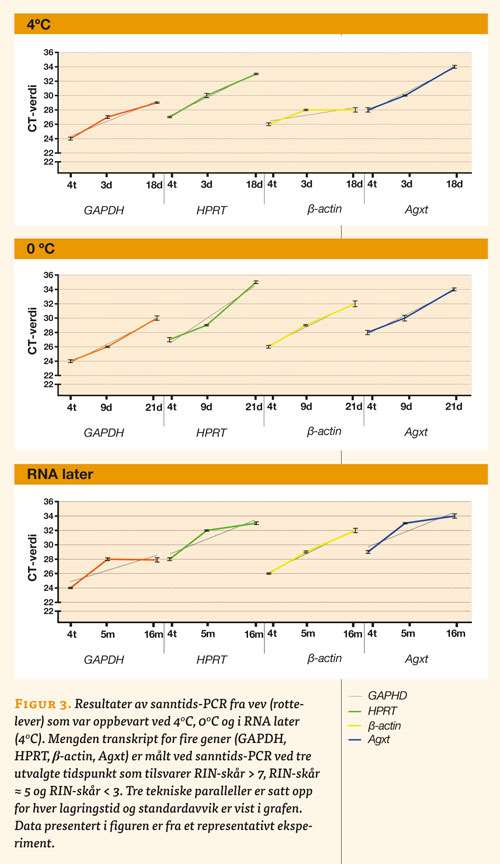
Prøver med tre forskjellige lagringsbetingelser og ulike lagringstider ble analysert med sanntids-PCR. Det ble valgt ut lagringstider som representerer henholdsvis RIN-skår over 7, RIN-skår rundt 5 og RIN-skår under 3 (tabell 2):
- 4 ºC etter fire timer, tre og 18 dager
- 0 ºC etter fire timer, ni og 21 dager
- RNA-later etter fire timer, fem og 16 måneder
Amplifikasjonskurvene for sanntids-PCR-analysene viser identiske mønstre for alle de fire utvalgte genene (figur 3). Resultatene viser at det er en forskjell på cirka 2 til 3 CT-verdier mellom den første og den andre amplifikasjonskurven, som tilsvarer RIN-skår > 7 og RIN-skår ≈ 5. Forskjellen mellom den andre og den tredje amplifikasjonskurven, som tilsvarer RIN-skår ≈ 5 og RIN-skår < 3, varierer fra ingen til 5 CT-verdier (figur 3, under). Amplifikasjonskurven for referanseprøven (materiale som var nedfryst umiddelbart i flytende nitrogen (-196 ºC) og videre oppbevart ved -80 ºC) var cirka 2 til 3 CT-verdier lavere enn for de tre forskjellige lagringstidene (resultat ikke vist).
Diskusjon
RIN-skår
RIN-skår blir ofte brukt som en pålitelig og informativ, standardisert metode for evaluering av RNA-kvalitet i forbindelse med genekspresjonsanalyser (9). For å undersøke omfanget av RNA-degradering i vev som var lagret under forskjellige forhold, ble en vevsbit valgt til RNA-ekstraksjon, og ekstraktet ble analysert med hensyn på RIN-skår. Vev lagret ved 22 ºC ble undersøkt for kvalitet nesten hver fjerde time. Resultatene viser at RIN-skår faller under 7 i løpet av 12 timers lagring, men at RIN-skår fortsatt holder seg rundt 6 i inntil 16 timer. Våre funn bekrefter resultatene fra en lignende studie utført av Botling og Micke (10). Først etter 21 timers lagring ved romtemperatur ble RIN-skår beregnet til 3. Det som er bemerkelsesverdig med våre resultater er den betydelige reduksjonen av RIN-skår i tidsrommet fra 16 til 21 timer, med et fall fra 6 til 3. Dette er i motsetning til de første 16 timene, da man ser en mer gradvis utvikling. Observasjonen kan tyde på at RNA-degraderingen i vev lagret ved romtemperatur eskalerer etter en viss tid. I motsetning til dette viser kvaliteten av RNA i vev lagret ved 4 ºC og 0 ºC en jevn reduksjon gjennom hele lagringsperioden. Etter tre dager ved 4 ºC er RIN-skår under 5, mens en slik verdi ikke opptrer før etter 12 dager ved 0 ºC. Vev lagret på RNA-later viser fortsatt en RIN-skår over 7 etter én måned, og først etter fem måneder måles RIN-skår rundt 6. Det ble bare gjort én måling etter dette tidspunktet på grunn av begrenset gjenværende vevsmateriale. Etter 16 måneder er RIN-skår 2,4, og det er derfor vanskelig å anslå presist når RIN-skår falt under 5. For videre arbeid ble det plukket ut materiale fra hver av lagringsbetingelsene, tilsvarende RIN- skår over 7, rundt 5 og under 3, for undersøkelse av morfologi og sanntids-PCR.
RIN-skår og morfologi
De observerte forandringene i morfologi følger fallet i RIN-skår, slik at ved RIN-skår > 7 observerte vi hovedsakelig normal struktur (figur 2A, 2D, 2G, 2J), mens tydelige strukturforandringer kom fram ved RIN-skår ≈ 5 (figur 2B, 2E, 2H, 2K). Dette gjelder ved alle lagringsbetingelser. Vi fant omtrent tilsvarende strukturelle forandringer i vev oppbevart ved 22 ºC i 12 timer, oppbevart ved 4 ºC i tre dager, ved 0 ºC i én måned og i RNA-later etter fem måneder. Alle disse prøvene hadde en RIN-skår på omtrent 5. Det tyder på at de prosessene som fører til degradering av RNA pågår parallelt med prosessene som fører til morfologiske strukturforandringer i vevet. Dette ser ut til å gjelde for alle lagringsbetingelser. For å kunne fastslå dette med større sikkerhet er det imidlertid nødvendig med mer omfattende undersøkelser.
Det er antatt at DNA og proteiner er mer stabile og robuste for degradering enn RNA. Ut fra dette kunne man forvente at strukturen i kjerne og cytoplasma skulle ha vist mindre endringer enn de man ser i RNA, men i prøver med lav RIN-skår ser vi en nesten total forandring av hele strukturen, noe som tyder på at proteolytiske og andre enzymer bryter ned også DNA og proteiner, samtidig som RNA degraderes. Det kunne derfor ha vært interessant å ekstrahere DNA og proteiner i tillegg til RNA, for å komplettere bildet av degraderingsprosessene.
Betydning av RNA-kvalitet for resultatene av sanntid-PCR
Mønsteret på amplifikasjonskurvene fra sanntid-PCR var nesten identiske for alle de fire utvalgte genene. Med lavere RIN-skår ble mengden påvisbart transkript redusert. Dette er uttrykt ved økende CT-verdi. Det var 2-3 CT-verdier forskjell for den første og andre amplifikasjonskurven (tilsvarer RIN-skår > 7 og RIN-skår ≈ 5). Mellom den andre og tredje amplifikasjonskurven (RIN-skår ≈ 5 og RIN-skår < 3) observerte man større variasjon, fra ingen til en forskjell på 5 CT-verdier. Dette tyder på at RNA med dårlig kvalitet (RIN-skår < 5) vil gi mer usikre og variable resultater i genekspresjonsanalyser.
Resultatene fra analysen av RIN-skår og amplifikasjonskurvene fra PCR, viste godt samsvar, slik at ved høyere RIN-skår fikk man en lavere CT-verdi og motsatt. Det samme ble observert for de tre lagringsbetingelsene som ble undersøkt, dvs. 4 ºC, 0 ºC og i RNA-later. Det kan tolkes som at RNA med RIN-skår > 5, kan gi meningsfulle resultater ved genekspresjonsanalyser, og prøver helt ned mot RIN-skår 3 kan benyttes. Men selv om man kan gjennomføre teknisk vellykkede analyser, vil resultatet være beheftet med større usikkerhet, siden lavere RNA-kvalitet fører til større variasjon mellom parallellene. Dette betyr i praksis at hvis man gjentok forsøket på nytt, ville man risikere å få avvikende resultater sammenliknet med forrige forsøk. Et større antall biologiske paralleller kan kompensere for dette, men generelt gjelder at dersom man er nødt til å utføre analyser på RNA med dårlig kvalitet, bør man tolke resultatene med forsiktighet.
Funnene korrelerer godt med at degradering av RNA skjer ved en prosess som innebærer hydrolyse av tilfeldige fosfodiesterbindinger i tilfeldige mRNA. Man vil da få en blanding av degraderte mRNA, med en kontinuerlig fordeling av korte og lange fragmenter, og med en gradvis forskyving i fordelingen mot kortere fragmenter. En andel av fragmentene vil da få brudd i området mellom primerne, og disse vil dermed ikke formeres eksponentielt i PCR reaksjonen.
Konklusjon
Resultatene viser at man for et gitt formål bør velge lagringsmetode avhengig av hvilket materiale som analyseres og hvor lenge det skal lagres. Om innsamlingen av materialet strekker seg over flere år, er det nødvendig å bruke svært lav temperatur for å sikre god kvalitet. Dette kan oppnås ved å lagre materialet ved -196 ºC i dampfasen over flytende nitrogen, eller ved -80 ºC i mekanisk fryser. For prosjekter som skal gjennomføres i løpet av korte tidsrom, kan man vurdere å bruke alternative lagringsmetoder med høyere temperatur som 0 ºC, 4 ºC eller til og med 22 ºC. Resultatene fra denne studien viser hvordan lavere temperatur fører til forsinkelse av RNA-degraderingen.
Man bør på forhånd foreta en vurdering av økonomiske konsekvenser av temperaturvalg innenfor den totale prosjektøkonomien. RNA-later er et utmerket og kostnadseffektivt middel for å øke holdbarheten på prøvematerialet, hvis det kun skal brukes til analyse av RNA.
I biobanksammenheng bør man tenke langt framover. Vi må forvente nye oppdagelser og etablering av nye metoder, så det er alltid usikkert hva det oppsamlede materiale i en biobank kan tenkes brukt til i framtiden og hvordan dette best kan skje. Derfor er det viktig at biobanker arbeider kontinuerlig for å bevare kvaliteten på det materialet som lagres.