Infertilitetsutredning starter som regel med en sædanalyse. Som for andre laboratorieanalyser forventes også sædanalysen å skulle gi nøyaktige og reproduserbare resultater. Dette forutsetter at metodene er standardiserte. En global standardisering er dessuten viktig for å kunne sammenligne resultater fra ulike laboratorier på tvers av landegrenser, følge endringer i sædkvalitet over tid og for å kunne delta i internasjonale studier. Sædanalysen er vanskelig å standardisere fordi den består av svært ulike metoder som er basert på subjektive vurderinger.
Verdens helseorganisasjon (WHO) publiserte de første retningslinjer for å undersøke en human sædprøve i en manual i 1980 (1) og har jevnlig revidert denne, sist i 2010 (2). Den siste utgaven av WHO-manualen er i større grad evidensbasert enn de tidligere utgavene. I tillegg til metodebeskrivelser er kvalitetssikring og kvalitetskontroll sentrale temaer. Standard sædanalyse omfatter celletelling og vurdering av spermiemotilitet og spermiemorfologi. Manualen omfatter også undersøkelser som gjøres i visse tilfeller og metoder som kun er anbefalt til forskningsformål.
Hensikten med artikkelen er å beskrive standard sædanalyse, utvalgte valgfrie tester, referanseverdier, kvalitetssikring og klinisk betydning av sædparameterne.
Materiale og metoder
Artikkelen bygger på WHO-manualen om sædanalyse fra 2010 (2), litteraturen referert til i denne og litteratursøk frem til 14.09.2017 i PubMed og Google Scholar. Søkeord som ble brukt; «sperm, spermatozoa, semen parameters, sperm concentration, sperm count, sperm motility, sperm morphology» i kombinasjon med «fertility». I tillegg ble det søkt med «sperm chromatin structure assay, computer aided sperm analysis, computer assisted sperm analysis». Søkeordet «TUNEL» (terminal deoxynucleotidyl transferase nick end labelling) ble kombinert med «sperm DNA fragmentation». Filteret «human» ble brukt i alle søk bortsett fra for «computer aided sperm analysis, computer assisted sperm analysis». Artikler ble valgt på grunnlag av populasjon, størrelse på studien og metodene som ble benyttet.
Denne oversiktsartikkelen baserer seg også på forfatternes erfaringer fra andrologiske laboratorier og egen forskning. Sisteforfatter (TBH) har ledet et andrologisk laboratorium og vært medlem i WHOs arbeidsgruppe om standardisering av sædanalysen. OW, JMA, HH og TBH har gjennomført kurs i standard sædanalyse organisert av European Society of Human Reproduction and Embryology og Nordic Association for Andrology.
Utstyr
WHO har som mål at sædanalysen skal kunne gjøres på laboratorier over hele verden og derfor ikke kreve kostbart utstyr. Basisutstyret omfatter vekt, sentrifuge, lysmikroskop, fasekontrastoptikk, immersjonsobjektiv, forbedret Neubauer tellekammer og manuell differensialcelleteller. For motilitetsanalyser ved 37 °C skal mikroskopet ha et oppvarmet objektbord. Siden sædprøven er viskøs, gjøres uttak til fortynning for celletelling med en "positive displacement"-pipette, der et stempel i spissen, og ikke luft, er i kontakt med væsken.
Sædprøven
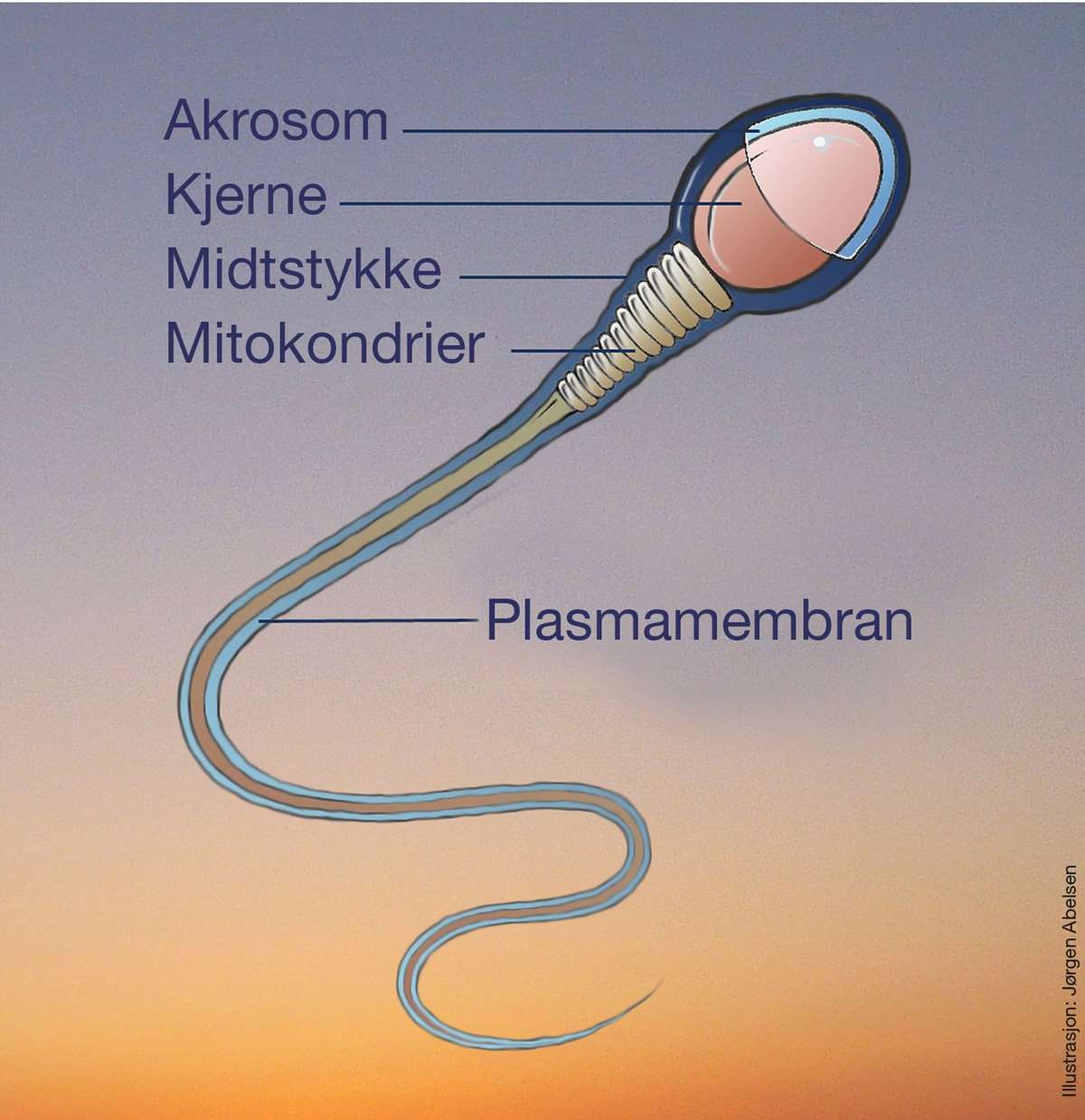
Spermatogenesen, dannelsen av spermiene, tar cirka 70 dager og skjer i de sædførende kanalene i testikkelen. Halen dannes i den siste fasen, kalt spermiogenesen, som varer i cirka tre uker og er temperaturfølsom. Spermiemodningen skjer i bitestikkelen, der spermiene lagres i en - to uker. Figur 1 viser en skjematisk fremstilling av en spermie og de ulike hoveddelene.
Sekret fra sædblærene utgjør i underkant 2/3 av ejakulatet, mens omtrent 1/3 kommer fra prostata. Kun en liten del av volumet kommer fra testiklene, bitestiklene og Cowpers kjertler (3). Ejakulasjonen er en sekvensiell prosess hvor den spermierike delen tømmes tidlig sammen med prostatasekretet, mens sædblærenes sekret kommer tilslutt sammen med et fåtall spermier. Kun fullstendige prøver skal analyseres.
Sædparametere kan variere hos samme mann både mellom to prøver tatt innenfor et begrenset tidsrom og over tid (4). Ved avvik fra referanseområdet bør en ny sædprøve analyseres. Feber kan påvirke sædkvaliteten. Hvis mannen har hatt feber de siste tre uken før sædprøven ble avlagt, bør ny prøve vurderes etter minst tre uker.
Innledende undersøkelse
Før analysestart oppbevares prøven mellom 20 °C og 37 °C, også under eventuell transport. I utgangspunktet er ejakulatet tyktflytende og ikke homogent. I løpet av kort tid vil prostataspesifikt antigen (PSA) som finnes i ejakulatet bryte ned koagelet og bidra til at prøven blir mer tyntflytende. Denne prosessen kalles likvifisering. Dersom prøven ikke er likvifisert innen 30 minutter, kan enzymatisk eller mekanisk behandling være nødvendig.
Sædprøven er hvitaktig og blakket. Rød-brun farge kan være tegn på at røde blodceller er tilstede. Gul farge kan forekomme etter lang abstinenstid, høye leukocyttnivåer, ved ikterus eller etter inntak av visse medikamenter og kosttilskudd.
Vanligvis inneholder sædprøven små mengder av andre celletyper, for eksempel epitelceller og "runde celler" som leukocytter og umodne kjønnsceller. Tilstedeværelse av et betydelig antall andre celler skal kommenteres. Dersom antallet "runde celler" overskrider 1x106/ml, skal den nøyaktige konsentrasjonen av disse bestemmes. Metoder for å påvise andre celler enn spermier er beskrevet i WHO-manualen.
Innledningsvis observeres ubehandlet sædprøve i mikroskop for å få et overblikk over spermiemotilitet, spermiekonsentrasjon, tilstedeværelse av agglutinater, aggregater eller andre celletyper enn spermier. Agglutinering skjer når spermier fester seg til hverandre via hode til hode eller hale til hale, forårsaket av antispermieantistoffer. Agglutinering kan påvirke konsentrasjon- og motilitetsbestemmelsene. Uspesifikke aggregater inneholder klumper av celler og cellerester og sees ofte når det er mange døde spermier.
Dersom ingen spermier observeres ved mikroskopering, sentrifugeres sædprøven, og det gjøres en ny vurdering for å se om det finnes spermier i prøven.
Spermiekonsentrasjon, sædvolum og totalt antall spermier
For bestemmelse av spermiekonsentrasjon og totalt antall spermier telles kun spermier med både hode og hale. Minst 200 celler telles i hvert av to separate uttak. Sædprøven avleveres i en forhåndsveid beholder, og sædprøvevolumet bestemmes ved veiing. Et lite volum kan tyde på en ufullstendig prøve eller delvis retrograd ejakulasjon (sæden tømmes i urinblæren), mens et høyt volum kan skyldes betennelse i sædblære eller prostata.
Totalt antall spermier i ejakulatet er produktet av spermiekonsentrasjonen og volumet av sædprøven og gir informasjon om spermieproduksjon og transport av spermier hos en mann.
Spermiemotilitet
Sædanalysen er særegen fordi den også omfatter evaluering av bevegelige celler. Vurdering av motilitet gjøres helst med rutenett i okularet. Alternativt til å se direkte i mikroskopet kan bildet av preparatet overføres til en skjerm ved hjelp av et kamera og evalueringen utføres ut fra skjermbildet. Prosedyren utføres i romtemperatur eller ved 37 °C. Temperaturen må standardiseres ved hvert laboratorium. Spermiene deles inn i tre bevegelseskategorier; i) progressivt motile, spermiene beveger seg målrettet fremover, ii) ikke-progressivt motile, spermiene beveger seg på stedet og iii) immotile, ubevegelige spermier.
Først vurderes de progressivt motile, så ikke-progressivt motile og til slutt immotile spermier. Minst 200 celler vurderes i hvert av to separate uttak. Resultatet angis som prosentandel spermier innen hver motilitetskategori av totalt vurderte spermier.
Progressiv motilitet har tidligere vært inndelt i rask og langsom (5). De to kategoriene ble slått sammen i 2010-manualen fordi enkelte mente det var vanskelig å vurdere de raskt progressive nøyaktig og reproduserbart (6). Det er fremdeles uenighet i fagmiljøene om betydningen av å vurdere raskt progressive spermier (7).
Spermievitalitet
I WHO-manualen anbefales det å undersøke andelen levende celler hvis en prøve inneholder færre enn 40% progressivt motile spermier. Imidlertid bør også andelen ikke-progressivt motile tas i betraktning, og en vitalitetstest utføres hvis mer enn halvparten av spermiene er immotile (8). Immotilitet kan skyldes at spermien er død, men også at den har haledefekt.
Det finnes ulike metoder for å vurdere vitalitet. De fleste baserer seg på en fargeløsning som tas opp i døde celler på grunn av en skadet membran. I WHO-manualen anbefales eosin-nigrosin-farging. 200 spermier i hvert av to separate utstryk vurderes. Nigrosin farger bakgrunnen, og eosin farger døde celler. Hvite og svakt rosa celler klassifiseres som levende, mens røde og mørk rosa celler klassifiseres som døde (9). Figur 2 viser eosin-nigrosin-fargede spermier.
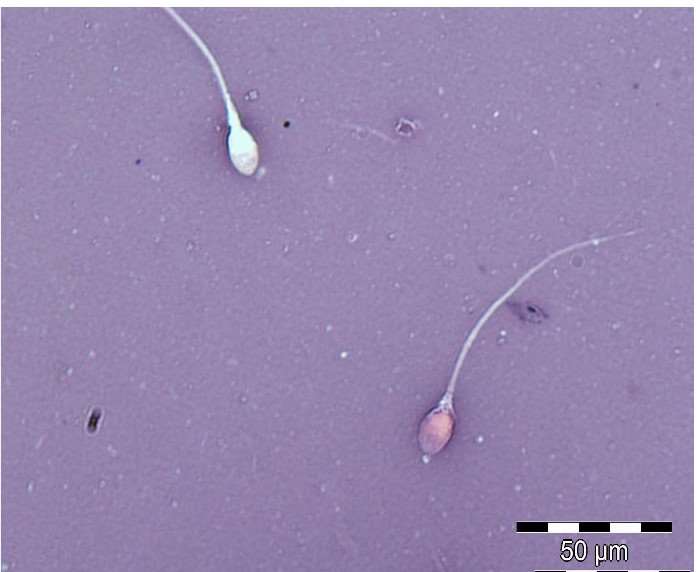
Hypo-osmotisk svelletest er en annen metode, også beskrevet i WHO-manualen, for å vurdere vitalitet. Et uttak av sædprøven inkuberes med en hypoosmotisk løsning, og cellene vurderes i mikroskopet. Halene til spermier med intakt membran vil svelle, og celler med svellet hale vurderes som levende (10).
Spermiemorfologi
Naturlig variasjon i spermienes utseende gjør vurderingen av morfologi vanskelig. En spermie defineres som morfologisk normal hvis hodet er 4-5 µm langt og 2,5-3,5 µm bredt med en jevn oval form (11). Akrosomet, som inneholder enzymer nødvendige for fertilisering, er tydelig definert og dekker 40-70% av hodet. Halen er omtrent 45 µm lang, og midtstykket er noe bredere enn halen og 7-8 μm langt.
Spermienes morfologi vurderes etter strikte kriterier i utstryk farget etter Papanicolaous metode (figur 3). Andel spermier med normal morfologi beregnes. Defekter kan deles inn i fire kategorier: hodefeil, midtstykkefeil, halefeil og cytoplasmarester rundt hale og midtstykke som er større enn 1/3 av hodestørrelsen. Spermiene kan ha en eller flere defekter. Et ofte brukt mål på abnormalitet er teratozoospermiindeks. Det angir antall defekter per unormal spermie og kan bidra med nyttig informasjon.
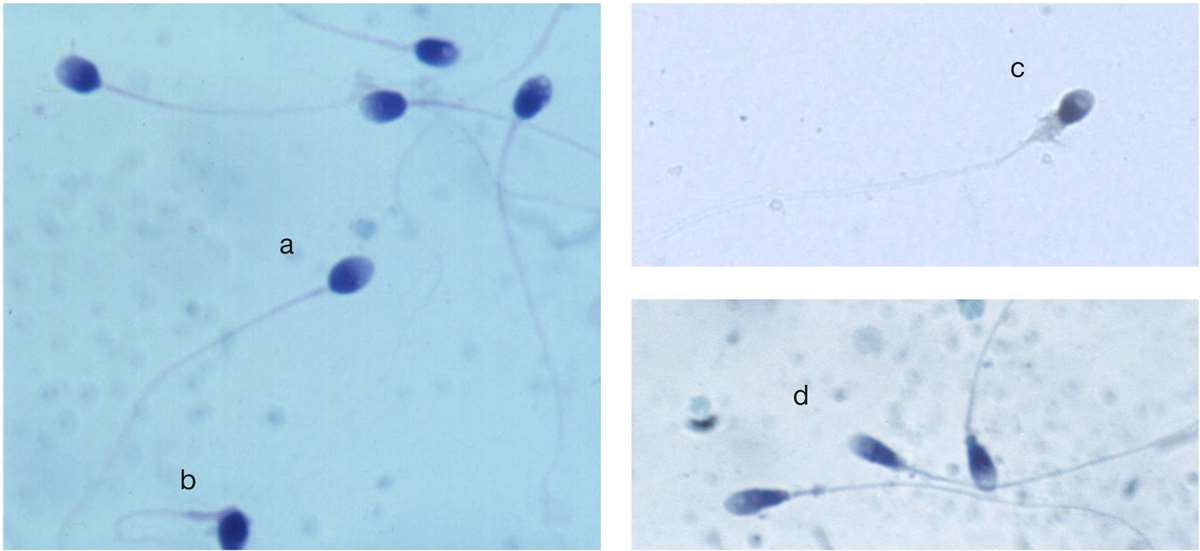
Minst 200 spermier vurderes i hvert av to separate områder, fortrinnsvis fra to ulike utstryk. WHO-manualen inneholder en stor samling bilder med tilhørende morfologivurderinger.
Kriteriene for vurderingen av en normal spermie har endret seg over tid og er omdiskuterte (12), noe som reflekteres i referansegrensene oppgitt i de ulike utgavene av WHO-manualen. I 1987 var nedre referansegrense 50% spermier med normal form (13). Som følge av endring til strikte kriterier, anbefales nå 4% som referansegrense for morfologisk normale spermier (14).
Antispermieantistoffer
WHO-manualen anbefaler to antiglobulintester for å påvise antistoffer direkte på spermiene. «Mixed antiglobulin reaction test» (MAR test) er basert på latekskuler eller behandlede erytrocytter dekket med antistoff mot humant globulin (anti-IgG eller anti-IgA) som binder IgG eller IgA på overflaten til uvaskede spermier. «Immunobead test» baseres på tilsvarende prinsipp, men gjøres med vaskede spermier. Andel motile spermier med kuler bundet til overflaten vurderes. Minst 200 celler bør telles.
Antispermieantistoffer kan redusere spermienes evne til fertilisering og kan være av klinisk betydning dersom mer enn 50% av de motile spermiene har antistoffer bundet til seg (15).
Andre metoder
WHO-manualen beskriver også valgfrie, biokjemiske analyser i sædvæsken og spermiefunksjonstester og undersøkelse av DNA-skade for forskning.
Vi vil kort omtale metoder for DNA-skade i spermier fordi det lenge har vært interesse for dette, og analysene gjøres ved en del fertilitetsklinikker. En av de mest brukte er test av spermiekromatinstruktur (sperm chromatin structure assay, SCSA) som ble utviklet for å måle skade i spermiens DNA (16). Metoden er kostbar da den er basert på væskestrømscytometri og lisensiert programvare. Protokollen ble standardisert for mange år siden (17). Den andre metoden som ofte benyttes, måler inkorporering av merkede nukleotider i skadet DNA ved hjelp av deoksynukleotidyltransferase (terminal deoxynucleotidyl transferase nick end labelling, TUNEL). Protokollen ble nylig standardisert (18).
Betydningen for fertilitet er uklar, både når det gjelder naturlig og assistert befruktning. En nylig publisert metaanalyse viser at DNA-skade i spermier har en negativ effekt på graviditetsraten etter in vitro-fertilisering (19).
Automatisert sædanalyse
Det er utviklet teknologi for automatisert sædanalyse, og de første systemene ble kommersialisert på 80-tallet. Ofte brukes forkortelsen CASA (computer-aided sperm analysis eller computer-assisted sperm analysis), som vil bli brukt i den følgende omtalen. Hensikten med denne teknologien har vært å oppnå en mer objektiv måling av spermiekonsentrasjon og spermiemotilitet sammenliknet med de manuelle metodene. Teknologien gir også en mer detaljert beskrivelse av spermienes bevegelsesmønster; kinematikken. I tillegg har det vært forventninger om at sædanalysen kunne utføres raskere enn med de manuelle metodene.
CASA har gitt gode resultater innenfor veterinærmedisin (20), men det har frem til nå vært vanskelig å få pålitelige og reproduserbare resultater for humane sædprøver. De noe urealistiske forventninger til CASA er hittil ikke innfridd, og metoden er ikke anbefalt som standard metode av WHO, men beskrevet i manualen som en valgfri metode.
Det foregår stadig utvikling av CASA-teknologien, og flere systemer er på markedet. Et CASA-system består av et mikroskop, et videokamera og en programvare. Når en sædprøve plasseres under mikroskopet, blir det tatt opp en kort film, vanligvis i ett til to sekunder, som så blir digitalisert og delt opp i flere bilder ved hjelp av programvaren. Celletelling og kinematisk analyse gjøres samtidig, og det benyttes fasekontrast optikk, som ved manuell vurdering. Hver spermie blir identifisert på bakgrunn av hvor mange piksler spermiehodet dekker, og hodet spores gjennom opptaket. Kinematikk og motilitet for alle spermiene beregnes.
CASA kan generere store mengder informasjon om en sædprøve, men det vanskelig å standardisere analysen, ikke minst fordi ulike variabler vurderes samtidig. Det kan dessuten være stor usikkerhet i analyseresultatet som følge av viskositet, celleaggregering og tilstedeværelse av andre partikler i prøven. Partikler kan oppfattes som spermier av systemet, og usikkerheten kan derfor være mindre når spermiene er separert fra sædvæsken og suspendert i medium. Med de nye CASA-systemene kan både spermiehode og hale identifiseres, noe som gjør det lettere å skille spermier fra andre partikler.
CASA kan ha et stort potensial innenfor forskning og klinisk bruk, men det forutsetter bedre teknologi (21).
Referanseverdier
Referansepopulasjonen for sædvariabler er menn som har gjort sin partner gravid i løpet av det siste året, og der tid før oppnådd graviditet er 12 måneder eller kortere. Selv om standardmetoder benyttes og laboratoriene deltar i eksternt kvalitetskontrollprogram, kan prøvesvar variere mellom laboratoriene. Variasjon kan også skyldes regionale og etniske forskjeller i sædkvalitet (22). WHO anbefaler at det enkelte laboratorium etablerer egne referanseområder, men det er i praksis krevende å få gjennomført. De norske referanseområdene som ble foreslått i 2006 (23), avviker i liten grad fra WHOs anbefalinger (2) (tabell 1).
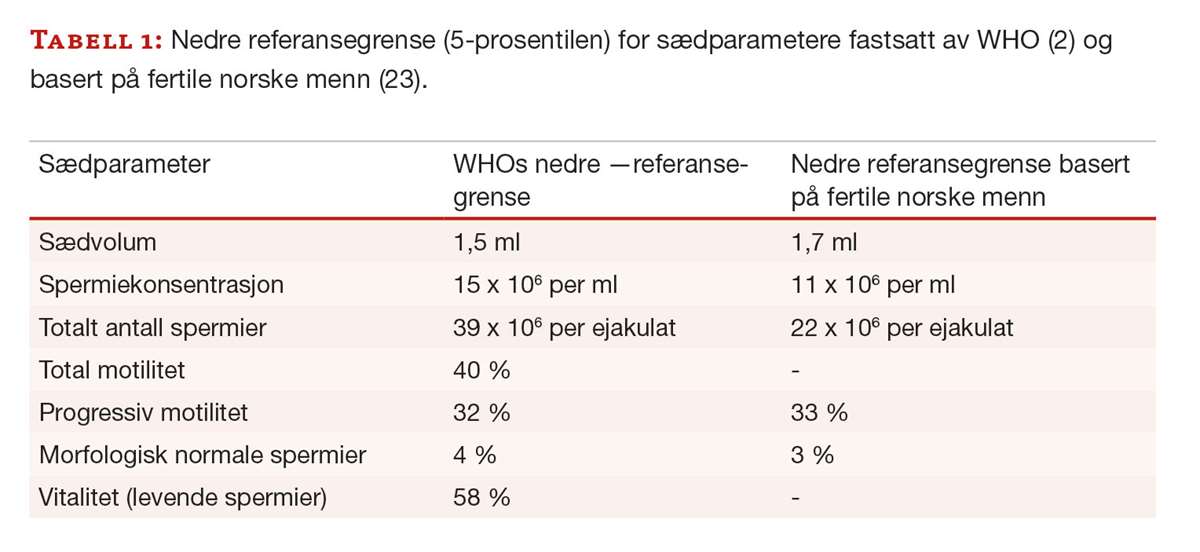
Referanseområdet for målinger er ofte det sentrale 95 %-intervallet, det vil si avgrenset av 2,5- og 97,5-prosentilene. For sædvariabler kan det være mer hensiktsmessig å benytte det øvre 95 %-intervallet som referanseområde (tabell 1) siden høye verdier sannsynligvis ikke er ugunstig for fertiliteten.
Kvalitetssikring og kvalitetskontroll
Kvalitetssikring er viktig for å standardisere sædanalysen. Målet er å oppnå prøvesvar som har stor grad av nøyaktighet og presisjon, og kvalitetskontroll skal sørge for at man oppdager og korrigerer tilfeldige og systematiske feil. Sentralt i den interne kvalitetskontrollen for sædanalyser er å avdekke forskjeller mellom laboratoriepersonell. Ekstern kvalitetskontroll er vesentlig for å korrigere systematiske feil og avvik som kan oppstå over tid og dermed oppnå sammenliknbare resultater med andre laboratorier. I eksterne kvalitetsprogrammer distribueres konserverte sædprøver til celletelling, videoer til motilitetsbestemmelse og utstryk til morfologibedømmelse. Avvik over tid kan også oppdages i internkontroll ved at lagrede prøver, motilitetsvideoer og utstryk evalueres på nytt ved samme laboratorium. I WHO-manualen er det detaljert beskrevet hvordan kvalitetssikring og kvalitetskontroll bør utføres.
WHO anbefaler at minst 200 spermier vurderes i to paralleller i evalueringen av de ulike sædvariablene. Dersom differansen mellom to paralleller ikke er akseptabel, foretas målinger i to nye parallelle uttak for celletelling og spermiemotilitet og ny evaluering av samme preparat til morfologi og vitalitet. I WHO-manualen er det tabeller som viser akseptabel differanse mellom parallellene i evaluering av de ulike sædvariablene (2).
Usikkerheten i resultatet vil være høyere hvis cellekonsentrasjonen i prøven er lav og telletallet av den grunn lavere enn 200. Det må kommenteres i rapporten.
Klinisk betydning
Sædprøvesvaret vil kunne si noe om sannsynligheten for befruktning (24), men er kun en av flere vurderinger som gjøres i fertilitetsutredningen. Kvinnens reproduktive helse har stor betydning for om graviditet inntreffer, og det gjøres en samlet utredning av paret. Det kan være uforklarlige årsaker til infertilitet, og et par kan oppleve ufrivillig barnløshet selv om kvinnen og mannen tilsynelatende ikke er subfertile, dvs har redusert fertilitet.
Den kliniske nytteverdien av referanseverdiene er omdiskutert (25, 26), men kan være nyttige som sammenlikningsgrunnlag, forutsatt en forståelse av hva de bygger på. Studier av unge par som sluttet å bruke prevensjon for å oppnå graviditet, viste at sannsynligheten for graviditet økte med økende spermiekonsentrasjon opp til 40 og 55 x 106/ml, avhengig av studie (27, 28). Disse resultatene kan tyde på at en mann kan være subfertil selv om spermiekonsentrasjonen er over 5-prosentilen i WHOs referansepopulasjon, som er 15 x 106/ml.
Progressiv spermiemotilitet er vist å ha best prediktiv verdi for fertilitet i noen studier (23, 29-31), mens andre studier ikke har kunne påvise sammenheng mellom spermiemotilitet og sannsynlighet for graviditet (27, 28).
Selv om noen studier tyder på at spermiemorfologi kan ha betydning for fertiliteten (27, 28), har uenighet om kriterier og endringer i disse ført til at det er vanskelig å tolke den kliniske betydningen av denne parameteren (32).
Både spermiekonsentrasjon og spermiemotilitet er av betydning for valg av behandlingsmetode ved fertilitetsklinikker. Dersom det ikke finnes spermier i ejakulatet, kan spermier i noen tilfeller hentes ut fra bitestikkel eller testikkel ved kirurgi, og brukes i behandling med intracytoplasmatisk spermieinjeksjon (ICSI).
Konklusjon
Sædanalysen er vesentlig i utredningen av par som opplever uønsket barnløshet. Denne artikkelen understreker viktigheten av å standardisere sædanalysen, både av hensyn til diagnostikk og behandling, men også av hensyn til forskningssamarbeid. For å oppnå standardisering kreves god opplæring av personalet og implementering av rutiner for intern og ekstern kvalitetskontroll ved laboratoriet. WHO har utgitt retningslinjer for hvordan sædanalysen bør utføres og har etablert referanseområder for sædparametere basert på fertile menn. Automatisert analyse har potensial til å gi en mer objektiv og rask vurdering av sædprøven enn de manuelle metodene, men anbefales per i dag ikke som standard metode.
Takk
Takk til professor emeritus Roelof Menkveld ved Stellenbosch University, Sør-Afrika for spermiemorfologibilder i figur 3.
Interessekonflikter
Ingen.